题目内容
11.在热的稀硫酸溶液中溶解了45.6gFeSO4.当加入200mL0.5mol•L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是( )| A. | N2O | B. | NO | C. | N2O3 | D. | NO2 |
分析 Fe2+失电子被氧化为Fe3+,硝酸中氮元素得电子化合价降低作氧化剂,利用电子转移守恒计算还原产物中N元素化合价,进而确定生成气体的化学式.
解答 解:n(FeSO4)=$\frac{45.6g}{152g/mol}$=0.3mol,n(KNO3)=0.02L×0.5mol/L=0.01mol,
Fe2+失电子被氧化为Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,
设N元素在还原产物中化合价为x,由电子转移守恒可知:
0.03mol×(3-2)=0.01mol×(5-x),
解得x=+2,
只有NO中N元素的化合价为+2价,
故选B.
点评 本题考查氧化还原反应的计算,明确氧化还原反应中得失电子相等是解本题的关键,难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:K+、Fe2+、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | 与铝反应生成氢气的溶液中:NH${\;}_{4}^{+}$、K+、Cl-、SiO${\;}_{3}^{2-}$ |
19.下列物质在一定条件下可与CH4发生化学反应的是( )
| A. | 氢气 | B. | 溴水 | C. | 氧气 | D. | 酸性KMnO4溶液 |
6.下列关于元素周期表的说法中不正确的是( )
| A. | 催化剂一般在过渡元素中寻找 | |
| B. | 过渡元素全部是金属元素,因此它们又被称为过渡金属 | |
| C. | 元素周期表中只有7个主族和7个副族 | |
| D. | 稀有气体元素原子的最外层电子数为2或者8 |
3.将m1 g的氢氧化钠和碳酸氢钠的固体混合物在300℃条件下充分加热,排出分解产生的气体,得到固体的质量为m2 g,设$\frac{{m}_{2}}{{m}_{1}}$=a,下列有关说法正确的是( )
| A. | a的取值范围是$\frac{53}{84}$<a<$\frac{53}{62}$ | |
| B. | a=$\frac{53}{65}$,固体成分为碳酸钠和氢氧化钠 | |
| C. | a=$\frac{53}{75}$时,固体成分为碳酸钠 | |
| D. | 加热过程中产生二氧化碳的物质的量总是小于水的物质的量 |
20.标准状况下,1mol H2和1mol H2O相同的是( )
| A. | 质量 | B. | 体积 | C. | 原子数 | D. | 分子数 |
10.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:查询资料,得有关物质的数据如下表: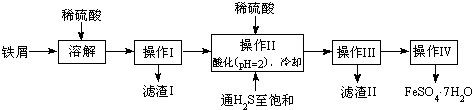
(1)检验制得的绿矾晶体中是否含有Fe3+,可以选用的试剂为AD.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
④若定容时,视线高于液面,所测得的FeSO4•7H2O的质量分数偏高.(填“偏高”、“偏低”、“无影响”

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
④若定容时,视线高于液面,所测得的FeSO4•7H2O的质量分数偏高.(填“偏高”、“偏低”、“无影响”
 金刚烷、立方烷的合成在有机合成史上具有理论意义.
金刚烷、立方烷的合成在有机合成史上具有理论意义.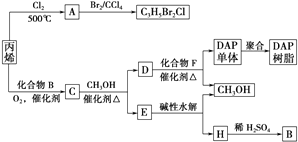
 .
.