题目内容
已知拆开 1mol H-H键、1mol I-I、1mol H-I 键分别需要吸收的能量为436kJ、151kJ、299k J.则由氢气和碘反应生成 1mol HI需要
放出
放出
(填“放出”或“吸收”)5.5
5.5
k J的热量.分析:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:解:在反应H2+I2?2HI中,断裂1molH-H键,1molI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,则由氢气和碘反应生成1molHI需要放出5.5kJ的热量,故答案为:放出;5.5.
点评:本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
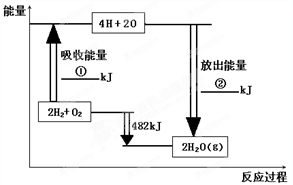 已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:
已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题: 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).