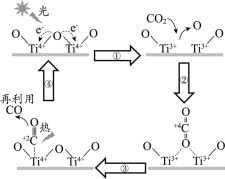
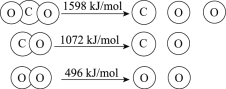
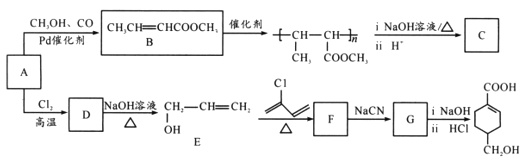
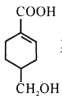
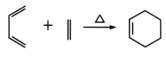题目内容
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体CO2的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一。
已知:①H2和CH4的燃烧热分别为285.5kJ/mol和890.0kJ/mol。
②H2O(1)=H2O(g) ΔH=+44kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式__。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1=__,此时n2=3.则反应I的平衡常数Kp=__(无需带单位,用含总压p的式子表示。已知:气体各组分的分压p(B),等于总压乘以其体积分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。

(4)用活性炭还原法可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是__填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
F.适当升高温度
【答案】CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=-164kJ·mol-1 1.0mol
CH4(g)+2H2O(g) ΔH=-164kJ·mol-1 1.0mol ![]() 温度超过250℃时,催化剂的催化效率降低,化学反应速率降低 温度升高,化学反应速率加快 CD
温度超过250℃时,催化剂的催化效率降低,化学反应速率降低 温度升高,化学反应速率加快 CD
【解析】
(1)根据盖斯定律书写H2还原CO2生成CH4和H2O(g)的热化学方程式;
(2)CO2(g)+H2(g)![]() CO(g)+H2O(g)反应前后气体物质的量不变,平衡后压强减小,是因为发生反应CO2(g)+3H2(g)
CO(g)+H2O(g)反应前后气体物质的量不变,平衡后压强减小,是因为发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),根据物质的量比等于压强比计算反应生成甲醇的物质的量;
CH3OH(g)+H2O(g),根据物质的量比等于压强比计算反应生成甲醇的物质的量;
(3)根据图示,温度超过250℃时,催化剂的催化效率降低;温度升高,化学反应速率加快;
(4)该反应是反应前后气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后各物质浓度增大。
(1)由H2和CH4的燃烧热分别为285.5kJ/mol和890.0kJ/mol。可知
①H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol ;
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
③H2O(1)=H2O(g) ΔH=+44kJ/mol
根据盖斯定律①×4+③×2-②得CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=-164kJ·mol-1 ;
CH4(g)+2H2O(g) ΔH=-164kJ·mol-1 ;
(2)反应前气体的物质的量是12mol,压强为p0=1.2p,反应后气体压强变为P,则反应后气体的物质的量是12![]() =10mol,设生成甲醇的物质的量是n1,
=10mol,设生成甲醇的物质的量是n1,
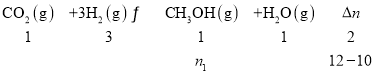
所以n1=1;则该反应生成水1mol,消耗CO2 1mol、消耗H2 3mol,此时n2=3,则CO2(g)+H2(g)![]() CO(g)+H2O(g)反应生成2mol H2O ,消耗2mol CO2、消耗2mol H2,所以容器中CO2、H2的物质的量分别是2mol、2mol;反应I的平衡常数Kp=
CO(g)+H2O(g)反应生成2mol H2O ,消耗2mol CO2、消耗2mol H2,所以容器中CO2、H2的物质的量分别是2mol、2mol;反应I的平衡常数Kp=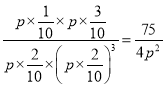 ;
;
(3)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低; 温度升高,增大活化分子的百分数,化学反应速率加快,所以300~400℃时,乙酸的生成速率升高;
(4)A.通入一定量的CO2,平衡逆向移动,平衡后N2浓度减小,故不选A;
B.加入合适的催化剂,平衡不移动,各物质浓度不变,故不选B;
C.适当缩小容器的体积,各物质浓度均同种程度增大,故选C;
D.通入一定量的NO,相当于加压,各物质浓度均同种程度增大,故选D;
E.加入一定量的活性炭,加入固体,平衡不移动,气体浓度不变,故不选E;
F.正反应吸热,适当升高温度,平衡正向移动,NO浓度降低,故不选F。

【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
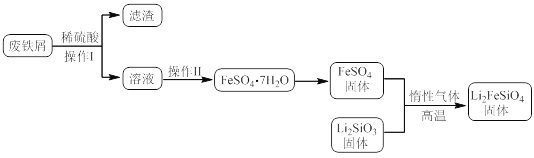
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二)Li2FeSiO4含量测定:
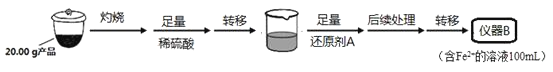
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B__,仪器C__。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是__。
(3)操作Ⅱ的步骤__,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需__。
(4)还原剂A可用SO2,写出该反应的离子方程式__,此时后续处理的主要目的是__。
(5)滴定终点时现象为__;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为_。