题目内容
【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
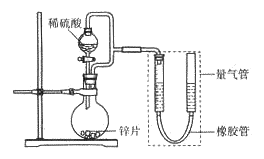
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。
【答案】 在其他条件一定时,化学反应速率随反应物浓度的增大而增大 BD BC 量器管左管水面上升,右管水面下降
【解析】本题考查实验方案设计与评价,(1)①对比两者,其他条件相同,硫酸浓度不同, t1>t2,因此得出结论是:其他条件不变,反应物浓度越大,反应速率越快;②换成粗锌片,反应速率加快,说明构成原电池,锌作负极,银、铜、石墨作正极,SiO2不导电,因此选项BCD正确;(2)①本实验研究吸氧腐蚀, A、盐酸呈现酸性,发生析氢腐蚀,故A错误;B、NaCl溶液显中性,可以验证吸氧腐蚀,故B正确;C、乙醇属于非电解质,不能构成原电池,故C错误;D、NaOH属于电解质,构成原电池,可以形成吸氧腐蚀,故D正确;(3)发生吸氧腐蚀,造成烧瓶内部压强减少,因此出现器管左管水面上升,右管水面下降。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是________.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:________.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是________. 用离子方程式解释产生气泡的原因:________.
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是________.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是________.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
A | 正极 | NaOH | Al﹣3e﹣=Al3+ | 2H2O+2e﹣=2OH﹣+H2↑ |
B | 负极 | 稀盐酸 | 2Al﹣6e﹣=2Al3+ | 6H++6e﹣=3H2↑ |
C | 正极 | 浓硝酸 | Cu﹣2e﹣﹣=Cu2+ | 2NO3﹣+4H+﹣4e﹣=2NO2↑+2H2O |
D | 负极 | 稀硝酸 | Cu﹣2e﹣=Cu2+ | 2NO3﹣+8H+=2NO↑+4H2O+6e﹣ |
其中正确的是________,由此推知,金属作电极不仅与本身性质相关,而且与_________有关.