题目内容
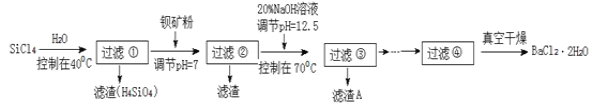
【题目】SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
已知:①常温下Fe3+ 、Mg2+ 完全沉淀的 pH 分别是3.4、12.4。
②Ge与Si同主族位于Si的下一周期。
(1)Ge的原子序数________
(2)请用电子式表示C2H2的形成过程_____________________________。
(3)SiCl4发生水解反应的化学方程式____________________________。
(4)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式_____________________________________。
(5)加钡矿粉调节pH=7的作用是:①使BaCO3转化为BaCl2;②________________________
(6)生成滤渣A的离子方程式:______________________________;
(7)BaCl2滤液经__________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(8)10 吨含78.8% BaCO3的钡矿粉理论上最多能生成 BaCl2·2H2O___________吨。
【答案】32 ![]() +
+![]() +
+![]() +
+![]() →
→![]() SiCl4+4H2O=H4SiO4↓+4HCl 3SiCl4+4NH3
SiCl4+4H2O=H4SiO4↓+4HCl 3SiCl4+4NH3![]() Si3N4+12HCl 使Fe3+完全转化为沉淀 Mg2++2OH-=Mg(OH)2↓ 蒸发浓缩 降温结晶 9.76
Si3N4+12HCl 使Fe3+完全转化为沉淀 Mg2++2OH-=Mg(OH)2↓ 蒸发浓缩 降温结晶 9.76
【解析】
由流程图可知,SiCl4在40℃条件下强烈水解生成盐酸和原硅酸沉淀;过滤,向盐酸中加入钡矿粉,调节溶液pH=7时,碳酸钡溶解转化为含有MgCl2的BaCl2溶液,Fe3+完全转化为氢氧化铁沉淀;过滤,70℃条件下,向含有MgCl2的BaCl2溶液中加20%NaOH溶液调节溶液pH=12.5时,镁离子完全沉淀生成氢氧化镁沉淀和BaCl2溶液;过滤,BaCl2溶液经蒸发浓缩、降温结晶、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(1)Ge位于元素周期表第四周期ⅣA族,原子序数为32,故答案为:32;
(2)碳原子与氢原子结合生成乙炔,其形成过程为:![]() +
+![]() +
+![]() +
+![]() →
→![]() ,故答案为:
,故答案为:![]() +
+![]() +
+![]() +
+![]() →
→![]() ;
;
(3)氯化硅水解生成原硅酸和盐酸,水解的化学方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(4)粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,则根据原子守恒可知反应中还有氯化氢生成,因此该反应的化学方程式为3SiCl4+4NH3![]() Si3N4+12HCl,故答案为:3SiCl4+4NH3
Si3N4+12HCl,故答案为:3SiCl4+4NH3![]() Si3N4+12HCl;
Si3N4+12HCl;
(5)pH=3.4时,三价铁离子完全生成沉淀,使Fe3+完全沉淀,盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2,同时使Fe3+完全转化为沉淀,故答案为:使Fe3+完全转化为沉淀;
(6)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成氢氧化镁,Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁,则生成滤渣A的离子方程式为Mg2++2OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓;
(7)从滤液中得到氯化钡晶体的操作是BaCl2溶液经蒸发浓缩、降温结晶、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O,故答案为:蒸发浓缩;降温结晶;
8)根据原子守恒可知10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量是![]() =9.76t,故答案为:9.76。
=9.76t,故答案为:9.76。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组在实验室制取Na2O2。查阅资料可知,钠与空气在453~473 K之间可生成Na2O,迅速提高温度到573~673 K之间可生成Na2O2,若温度提高到733~873 K之间Na2O2可分解。除Li外其他碱金属不与N2反应。
(1)甲组设计制取Na2O2装置如图。
①使用该装置制取的Na2O2中可能含有的杂质为________。
A.Na3N B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如下:
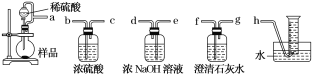
烧瓶中发生的主要反应的化学方程式是______________________。分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果________(填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是________。
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果________(填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是____(填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是____________________。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需要测定的有关数据_________________________________________________________________。