题目内容
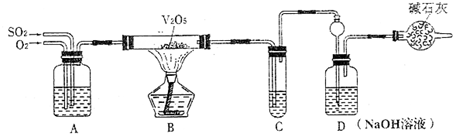
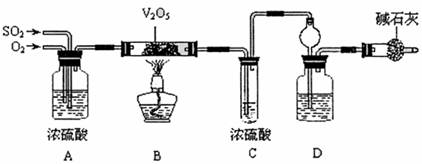
某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率.已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2.
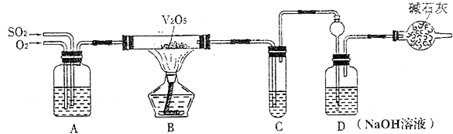
请回答下列问题:
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为______.
(2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是______;装置C中浓硫酸的作用为______.
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是______.
(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg.若装置D增加的质量为a g,则此条件下二氧化硫的转化率是______(用含字母的代数表示,结果可不化简).

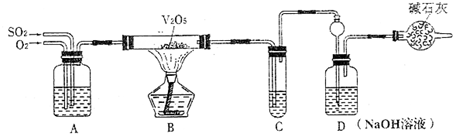
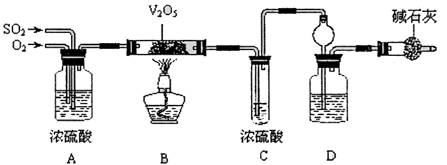
请回答下列问题:
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为______.
(2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是______;装置C中浓硫酸的作用为______.
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是______.
(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg.若装置D增加的质量为a g,则此条件下二氧化硫的转化率是______(用含字母的代数表示,结果可不化简).
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,则1molSO2被O2氧化成气态SO3,放出98.3kJ热量,反应的热化学方程式为SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ?mol-1,故答案为:SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ?mol-1;
(2)依据反应2SO2+O2?2SO3可知,反应是可逆反应,A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,说明氧气对反应是过量的,促使平衡正向进行,可提高二氧化硫的转化率;装置C中浓硫酸的作用是吸收SO3,故答案为:提高二氧化硫的转化率;吸收SO3;
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到C装置中被浓硫酸吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收,故答案为:继续通入氧气一段时间;
(4)加入足量氯化钡生成沉淀为硫酸钡,实验结束后,稀释装置C中的溶液,C中是硫酸,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg判断为硫酸钡沉淀;若装置D增加的质量为a g,是剩余的二氧化硫的质量;气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2;依据SO2~SO3~H2SO4~BaSO4;根据反应关系计算反应的硫酸物质的量=硫酸钡物质的量=
mol;已知C中的浓硫酸含溶质m mol,因此,反应生成硫酸的二氧化硫物质的量=(
-m)mol;剩余二氧化硫物质的量=
mol;所以二氧化硫的转化率=
×100%,
故答案为:
×100%.
| 1 |
| 2 |
| 1 |
| 2 |
(2)依据反应2SO2+O2?2SO3可知,反应是可逆反应,A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,说明氧气对反应是过量的,促使平衡正向进行,可提高二氧化硫的转化率;装置C中浓硫酸的作用是吸收SO3,故答案为:提高二氧化硫的转化率;吸收SO3;
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到C装置中被浓硫酸吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收,故答案为:继续通入氧气一段时间;
(4)加入足量氯化钡生成沉淀为硫酸钡,实验结束后,稀释装置C中的溶液,C中是硫酸,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg判断为硫酸钡沉淀;若装置D增加的质量为a g,是剩余的二氧化硫的质量;气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2;依据SO2~SO3~H2SO4~BaSO4;根据反应关系计算反应的硫酸物质的量=硫酸钡物质的量=
| w |
| 233 |
| w |
| 233 |
| a |
| 64 |
| ||||
|
故答案为:
| ||||
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目