题目内容
(2012?南充模拟)在指定条件下,下列各组离子一定能大量共存的是( )
分析:A、使甲基橙试剂显红色的溶液为酸性溶液,考虑氧化还原反应而不能大量共存;
B、滴人KSCN显血红色的溶液中存在Fe3+,利用离子之间不反应来分析离子共存;
C、c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,利用复分解反应来分析离子的共存问题;
D、由水电离的c(H+)=1.0×10-13mol?L-1的溶液,水的电离受到抑制,可能为酸或碱的溶液,利用复分解反应来分析离子的共存.
B、滴人KSCN显血红色的溶液中存在Fe3+,利用离子之间不反应来分析离子共存;
C、c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,利用复分解反应来分析离子的共存问题;
D、由水电离的c(H+)=1.0×10-13mol?L-1的溶液,水的电离受到抑制,可能为酸或碱的溶液,利用复分解反应来分析离子的共存.
解答:解:A、因甲基橙试剂显红色的溶液为酸性溶液,H+、Fe2+、NO-3能发生氧化还原反应,则不能大量共存,故A错误;
B、因Fe3+不与该组离子之间发生化学反应,则能够大量共存,故B正确;
C、c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,OH-与NH+4结合生成弱电解质,OH-与Al3+结合生成沉淀,则不能大量共存,故C错误;
D、由水电离的c(H+)=1.0×10-13mol?L-1的溶液,该溶液为酸或碱的溶液,OH-与NH+4结合生成弱电解质,H+与AlO-2生成沉淀,HCO-3既能与酸反应又能与碱反应,则该组离子一定不能大量共存,故D错误;
故选B.
B、因Fe3+不与该组离子之间发生化学反应,则能够大量共存,故B正确;
C、c(OH-)/c(H+)=1012的溶液中,c(OH-)=0.1mol/L,OH-与NH+4结合生成弱电解质,OH-与Al3+结合生成沉淀,则不能大量共存,故C错误;
D、由水电离的c(H+)=1.0×10-13mol?L-1的溶液,该溶液为酸或碱的溶液,OH-与NH+4结合生成弱电解质,H+与AlO-2生成沉淀,HCO-3既能与酸反应又能与碱反应,则该组离子一定不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存问题,明确信息挖掘和使用及离子之间的反应是解答本题的关键,选项中的C、D是学生分析的难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
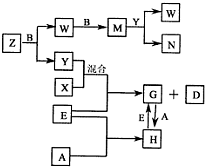 (2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):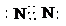
 5N2+6H2O
5N2+6H2O NH3?H2O+H+
NH3?H2O+H+
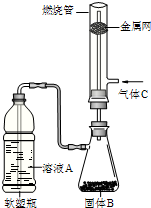 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
(2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
 VO2++2H++V2+.下列说法正确的是( )
VO2++2H++V2+.下列说法正确的是( )