题目内容
(2012?南充模拟)下列实验装置及操作正确的是( )
分析:A.乙酸乙酯易挥发,缺少吸收乙酸乙酯的装置;
B.原电池中发生氧化反应和发生还原反应的物质应处于不同的半电池中;
C.与溴水褪色的物质除了乙烯外,一些还原性的物质可被溴水氧化而使溴水褪色;
D.检验装置气密性常用的方法为微热法、液差法等.
B.原电池中发生氧化反应和发生还原反应的物质应处于不同的半电池中;
C.与溴水褪色的物质除了乙烯外,一些还原性的物质可被溴水氧化而使溴水褪色;
D.检验装置气密性常用的方法为微热法、液差法等.
解答:解:A.缺少吸收乙酸乙酯的装置,应把长导管伸入饱和碳酸钠溶液上方,故A错误;
B.负极半电池电解质应为氯化亚铁,正极半电池应为氯化铁溶液.故B错误;
C.制取乙烯实验中,会有还原性的气体二氧化硫生成,故检验乙烯前应先把二氧化硫吸收,故C错误;
D.此题采用微热法检验气密性,导管中页面高于广口瓶内液面,则气密性良好.故D正确.
故选D.
B.负极半电池电解质应为氯化亚铁,正极半电池应为氯化铁溶液.故B错误;
C.制取乙烯实验中,会有还原性的气体二氧化硫生成,故检验乙烯前应先把二氧化硫吸收,故C错误;
D.此题采用微热法检验气密性,导管中页面高于广口瓶内液面,则气密性良好.故D正确.
故选D.
点评:本题考察了对化学实验方案的评价.要掌握典型的实验原理和实验装置,从实验装置的设计、实验原理的合理性及实验目的等角度进行评价和判断.本题易错选C,要注意浓硫酸的强氧化性.

练习册系列答案
相关题目
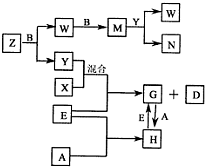 (2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
 5N2+6H2O
5N2+6H2O NH3?H2O+H+
NH3?H2O+H+
 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
(2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
 VO2++2H++V2+.下列说法正确的是( )
VO2++2H++V2+.下列说法正确的是( )