��Ŀ����
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol��L��1�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ�������ж���ȷ����(����)
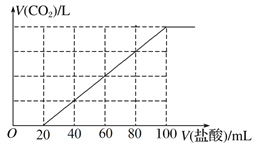
A. ͨ��CO2�����ʵ���Ϊ0.02 mol
B. ԭNaOH��Һ��Ũ��Ϊ0.12 mol��L��1
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��2
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��3��1
���𰸡�D
���������������е�ͼ������20mL��������Na2CO3��Ӧ����̼�����ƣ�����Һ����Na2CO3 xmol������NaHCO3mmol
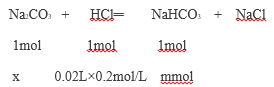
��ã�x=0.004mol��m=0.004mol
��80mL���ᷴӦ��NaHCO3�����ʵ���ymol������zmolCO2������
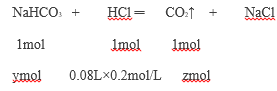
��ã�y=0.016mol��z=0.016mol������ͨ��CO2�����ʵ���Ϊ0.016 mol����A�������ڼ�������100mLʱ������NaOH ��NaHCO3����Na2CO3������NaCl�����ݻ�ѧ��Ӧ��ԭ���غ㣬����n(Na+)=n(Cl-)����n(NaOH)=n(HCl)=0.02moL,NaOH��Ũ��Ϊ![]() mol/L����B���������Ϸ�����������Һ��������̼���ƺ�̼��������û��������������C����ԭ��Һ��NaHCO3�����ʵ�����0.016mol��0.004mol=0.012mol��������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��0.012mol: 0.004mol =3��1����D��ȷ��
mol/L����B���������Ϸ�����������Һ��������̼���ƺ�̼��������û��������������C����ԭ��Һ��NaHCO3�����ʵ�����0.016mol��0.004mol=0.012mol��������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��0.012mol: 0.004mol =3��1����D��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������ʵ��װ�ã��г�װ������ȥ��������Ӧʵ�飬�ܴﵽʵ��Ŀ���ǣ�������
A | B | C | D | |
ʵ�� | ��ȥCl2�к��е�����HCl | ����NH4Cl������Һ�Ʊ�NH4Cl���� | ��ȡ����������CO2���� | ����CCl4��ȡ��ˮ���ѷֲ���л����ˮ�� |
װ�� |
|
|
|
|
A.A
B.B
C.C
D.D