题目内容
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
C.该过程中总反应为2Al+3Ag2S 6Ag+Al2S3 6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
B
解析试题分析:A、黑色会褪去,说明Ag2S转化为Ag,所以处理过程中银器的质量逐渐增大,错误;B、铝的活泼性大于银,所以银器为正极,Ag2S被还原生成单质银,正确;C、Al3+与S2?发生相互促进的水解反应,不能共存,溶液中Al2S3不能存在,所以不可能生成Al2S3,错误;D、黑色褪去的原因是黑色Ag2S转化为金属Ag,错误。
考点:本题考查原电池原理、化学方程式的书写。

生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池。其工作原理如图所示。下列有关说法正确的是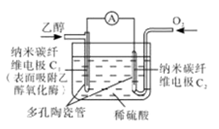
| A.O2在C2电极上得电子,被氧化 |
| B.电子由C2极经外电路流向C1极 |
| C.每转移6mole-,理论上生成22.4LCO2 |
| D.C1极的电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+ |
不久前,美国一个海军航空站安装了一 台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600 ℃~700 ℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O, 负极反应为H2+ CO32--2e-=H2O+CO2,则下列推断正确的是 ( )
| A.正极反应为:4OH- =O2+2H2O+4e- | B.放电时 CO32-向负极移动 |
| C.电池供应1 mol水蒸气,转移的电子数为4 mol | D.放电时CO32-向正极移动 |
针对下图装置的说法中,正确是
| A.溶液中pH值明显下降 |
| B.铁片为正极,镀锌铁片为负极 |
| C.阴极的电极反应式:Fe-2e→Fe2+ |
| D.电子由锌经溶液流向铁 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是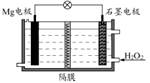
| A.Mg电极是该电池的正极 |
| B.石墨电极附近溶液的pH增大 |
| C.H2O2在石墨电极上发生氧化反应 |
| D.溶液中Cl-向正极移动 |
用石墨电极电解CuCl2溶液(见图)。下列分析正确的是
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2++2e-=Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-。下列叙述错误的是
| A.c电极是正极,发生还原反应 |
| B.B口通入的是甲烷,发生氧化反应 |
| C.放电时O2-离子向d极移动 |
| D.d极上的电极反应式为:CH4+4O2-+8e-=CO2↑+2H2O |
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+ Mg = Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
| A.Mg为电池的正极 |
| B.负极反应为AgCl+e-=Ag+Cl- |
| C.不能被KCl溶液激活 |
| D.可用于海上应急照明供电 |
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图。下列说法正确的是 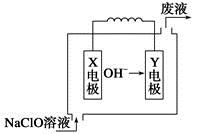
| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
D.X电极上发生的反应为ClO-+2H2O-4e-=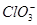 +4H+ +4H+ |