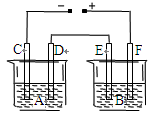
题目内容
用惰性材料作电极,分别电解下列物质,当相同电量时,下列指定的电极上析出气体质量最大的是
| A.熔融的NaCl(阳极) | B.NaCl溶液(阴极) |
| C.NaOH溶液(阴极) | D.Na2SO4(阳极) |
A
试题分析:电解熔融氯化钠、氯化钠溶液、氢氧化钠溶液和硫酸钠溶液的方程式分别为:2NaClO
 2Na+Cl2↑~2e-、2NaCl+2H2O
2Na+Cl2↑~2e-、2NaCl+2H2O 2NaOH+Cl2↑+H2↑~2e-、2H2O
2NaOH+Cl2↑+H2↑~2e-、2H2O 2H2↑+O2↑~4e-、2H2O
2H2↑+O2↑~4e-、2H2O 2H2↑+O2↑~4e-,由电解方程式可知,每转移2mol电子,电解熔融氯化钠阳极得到1mol氯气,质量是71g、电解氯化钠溶液阴极得到1mol氢气,质量是2g、电解氢氧化钠溶液阴极产生1mol氢气,质量是2g,电解硫酸钠溶液阳极产生0.5mol氧气,质量是16g,所以电极上析出气体质量最大的是氯气,答案选A。
2H2↑+O2↑~4e-,由电解方程式可知,每转移2mol电子,电解熔融氯化钠阳极得到1mol氯气,质量是71g、电解氯化钠溶液阴极得到1mol氢气,质量是2g、电解氢氧化钠溶液阴极产生1mol氢气,质量是2g,电解硫酸钠溶液阳极产生0.5mol氧气,质量是16g,所以电极上析出气体质量最大的是氯气,答案选A。
练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
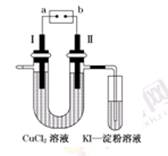

 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)