题目内容
8.下列实验现象,与括号内的物质没有关系的是( )| A. | 将NaHCO3固体加入新制的氯水中,有无色气泡(H+) | |
| B. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,发现呈红色(Cl2) | |
| C. | 将FeCl2溶液滴到氨水中生成的白色沉淀很快变色(O2) | |
| D. | 将FeCl3溶液滴到淀粉-KI试纸上,试纸变蓝(Cl-) |
分析 A.氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,溶液呈酸性;
B.氯化亚铁被氯气氧化生成氯化铁;
C.氯化亚铁与氨水反应生成具有还原性的氢氧化亚铁;
D.氯化铁氧化电离子生成碘.
解答 解:A.氯水显酸性,能与碳酸氢钠反应生成CO2气体,故A不选;
B.氯化亚铁具有还原性,被氯气氧化生成氯化铁,再滴加KSCN溶液,溶液呈红色,故B不选;
C.氯化亚铁与氨水反应生成具有还原性的氢氧化亚铁,可被氧化氧化生成氢氧化铁,故C不选;
D.氯化铁氧化电离子生成碘,与氯离子无关,故D选.
故选D.
点评 本题考查较为综合,涉及氯水的成分及氯气的化学性质、次氯酸的化学性质以及氨水、氯化铁等知识,明确氯水的成分是解答本题的关键,并熟悉各微粒的性质来解答即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.臭氧可以使湿润的淀粉碘化钾试纸变蓝,化学方程式为:KI+O3+H2O→KOH+I2+O2(未配平),下列叙述正确的是( )
| A. | O3在反应中被还原为O2 | |
| B. | 1mol O3在反应中得到2mol电子 | |
| C. | 该反应的还原产物为I2 | |
| D. | 反应中氧化产物与还原产物物质的量之比为1:3 |
3.下列说法不正确的是( )
| A. | Na2CO3比NaHCO3稳定得多 | |
| B. | NaHCO3比Na2CO3难溶于水 | |
| C. | 用物质的量相同的苏打和小苏打可得到相同质量的CO2 | |
| D. | 石灰水既能和Na2CO3反应,又能与NaHCO3反应,且反应原理相同 |
20.已知A、B、C、D为第三周期元素,其原子的第一至第四电离能如表所示:(单位:kJ/mol),回答下面各题:
(1)A是ArB是NaC是MgD是Al(填元素符号)
(2)B通常显+1价,B的电负性<C的电负性(填“>”、“<”或“=”).(3)元素C的第一电离能比D高的原因是镁的外围电子为3S2,处于全充满状态,能量较低,较稳定,所需第一电离能较大
(4)下列元素中,化学性质和物理性质最像A元素的是A.
A.氦(1s2) B.铍(1s22s2) C.锂(1s221) D.氢(1s1) (5)每种元素都出现相邻两个电离能的数据相差较大的情况,请你估计B的第2次电离 能飞跃数据将是第9电子.
| 元素代号 | I1 | I2 | I3 | I4 |
| A | 2080 | 4000 | 6100 | 9400 |
| B | 500 | 4600 | 6900 | 9500 |
| C | 740 | 1500 | 7700 | 10500 |
| D | 580 | 1800 | 2700 | 11600 |
(2)B通常显+1价,B的电负性<C的电负性(填“>”、“<”或“=”).(3)元素C的第一电离能比D高的原因是镁的外围电子为3S2,处于全充满状态,能量较低,较稳定,所需第一电离能较大
(4)下列元素中,化学性质和物理性质最像A元素的是A.
A.氦(1s2) B.铍(1s22s2) C.锂(1s221) D.氢(1s1) (5)每种元素都出现相邻两个电离能的数据相差较大的情况,请你估计B的第2次电离 能飞跃数据将是第9电子.
17.用如图所示实验装置进行相应实验,能达到实验目的是( )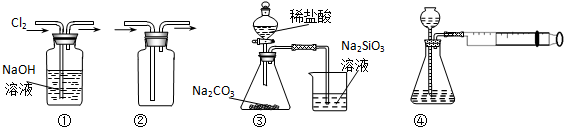

| A. | 装置①可用于除去Cl2中含有的少量HCl气体 | |
| B. | 装置④向左推动针筒活塞可检验该装置的气密性 | |
| C. | 装置③可证明非金属性Cl>C>Si | |
| D. | 按装置②所示的气流方向可用于收集H2、NH3等 |
18.前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示,下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 元素X和元素W最高正价代数和一定为8 | |
| B. | 若元素X的原子序数为a,则Z的原子序数一定为a+9. | |
| C. | 常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 | |
| D. | 原子半径的大小顺序为rW>rZ>rX>rY. |
