题目内容
【题目】根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A. Fe3+>Cl2>I2 B. Cl2>I2>Fe3+ C. Cl2>Fe3+>I2 D. I2>Cl2>Fe3+
【答案】C
【解析】氧化剂的氧化性大于氧化产物的氧化性,①2FeCl3+2KI═2FeCl2+2KCl+I2,Fe3+>I2,②2FeCl2+Cl2=2FeCl3,Cl2>Fe3+,则氧化性由强到弱的顺序为Cl2>Fe3+>I2,正确答案选C。

【题目】铁、铜、锌是常见三种金属,根据所学知识回答下列问题:
(1)下列关于三种金属的说法,正确的是_______(填选项字母)
A.三种金属的腐蚀以化学腐蚀为主
B.Fe能与很多分子或离子形成配位键
C.基态铜原子的电子排布式是1s22s22p63s23p103d94s2
D.铁属于黑色金属,在周期表中属下ds区元素
E.与锌同周期的所有副族元素的基态原子中,最外层电子数与锌相同的元素有5种。
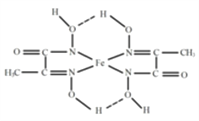
(2)某铁的化合物结构简式如图所示组成该化合物中属于p区元素的原子第一电离能由小到大的顺序为_________。该化合物中氮原子的杂化方式为_______。
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______,原因是___________。
(4)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJ·mol-1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是___________________________。
(5)向硫酸铜溶液中滴加过量氨水,观察到的现象是:首先生成蓝色沉淀。继续加氨水,沉淀溶解,得到深蓝色透明溶液。请写出上述过程沉淀溶解的离子方程式_______________。