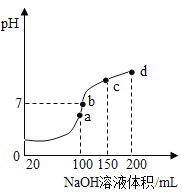
题目内容
【题目】实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,以甲基橙为指示剂,用0.10mol·L-1HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
A.NaClB.Ca(OH)2C.Na2CO3D.NaHCO3
【答案】B
【解析】
19.00mL 0.1000molL-1HCl标准液中含有HCl的物质的量为:0.1mol/L×0.019mol=0.0019mol,根据反应方程式:HCl+NaOH=NaCl+H2O可知,20.00mL配制的溶液中含有0.0019molNaOH,则1L该溶液中含有氢氧化钠的物质的量为:0.0019mol×![]() =0.095mol,溶液中含有氢氧化钠的质量为:40g/mol×0.095mol=3.8g<4.0g,说明含有的杂质在等质量时消耗HCl的物质的量小于NaOH,已知40g氢氧化钠消耗1molHCl。
=0.095mol,溶液中含有氢氧化钠的质量为:40g/mol×0.095mol=3.8g<4.0g,说明含有的杂质在等质量时消耗HCl的物质的量小于NaOH,已知40g氢氧化钠消耗1molHCl。
A.氯化钠不与氯化氢反应,含有氯化钠时消耗的氯化氢减少,满足条件,故A不选;
B.74g氢氧化钙消耗2molHCl,37g氢氧化钙消耗1molHCl,等质量时消耗的HCl大于氢氧化钠,不满足条件,故B选;
C.106g Na2CO3消耗2molHCl,53g Na2CO3消耗1mol氯化氢,等质量时消耗的氯化氢小于氢氧化钠,满足条件,故C不选;
D.84g NaHCO3消耗1mol盐酸,等质量时消耗的氯化氢小于氢氧化钠,满足条件,故D不选;
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目