题目内容
在Zn+H2SO4 = ZnSO4+H2反应中,2分钟内硫酸浓度由l.5 mol·L-1降至1.1 mol·L-1,则2分钟内用硫酸表示的平均反应速率为 ( )
A.0.1mol·L-1·min-1 B.0.2mo1·L-1·min-1
C.0.3mol·L-1·min-1 D.0.4mo1·L-1·min-1
【答案】
B
【解析】
试题分析:v(H2SO4)=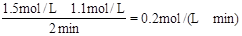 。答案选B。
。答案选B。
考点:化学反应速率的计算
点评:本题非常基础简单,只要根据公式计算即可。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
在Zn+H2SO4=ZnSO4+H2↑反应中,2分钟内硫酸浓度由1.5mol?L-1降至1.1mol?L-1,则2分钟内用硫酸表示的平均反应速率为( )
| A、0.1 mol?L-1?min-1 | B、0.2 mol?L-1?min-1 | C、0.3 mol?L-1?min-1 | D、0.4 mol?L-1?min-1 |
在Zn+H2SO4 = ZnSO4+H2反应中,2分钟内硫酸浓度由l.5 mol·L-1降至1.1 mol·L-1,则2分钟内用硫酸表示的平均反应速率为 ( )
| A.0.1mol·L-1·min-1 | B.0.2mo1·L-1·min-1 |
| C.0.3mol·L-1·min-1 | D.0.4mo1·L-1·min-1 |