题目内容
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
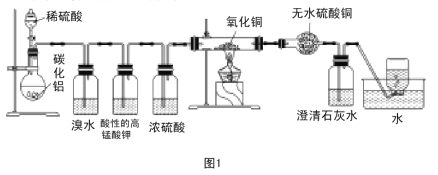
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
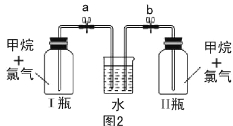
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
【答案】(1)Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑
(2)2CH4+7CuO![]() 7Cu+CO2+CO+4H2O
7Cu+CO2+CO+4H2O
(3)干燥甲烷 不能 (4)A
(5)CH4+Cl2![]() CH3Cl+HCl ABC
CH3Cl+HCl ABC
【解析】
试题分析:(1)已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷,用设1法配平可得:Al4C3 + 6 H2SO4 = 2 Al2(SO4)3 + 3 CH4↑;(2)由甲方案的目的是探究甲烷与氧化剂反应、实验测得消耗甲烷与氧化铜物质的量之比2∶7可知,设甲烷的系数为2,先后依据铜、氢、氧、碳原子个数守恒可得:硬质试管里可能发生的化学方程式为2 CH4 + 7 CuO ![]() 7 Cu + CO2 + CO + 4 H2O;(3)浓硫酸具有吸水性,且不能与甲烷反应,因此实验甲中浓硫酸起干燥甲烷的作用;集气瓶是尾气处理装置,其中收集到的不溶于水的气体主要是CO,CO气体有毒,不能直接排入空气;(4)A、酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应,A正确;B、硬质试管里黑色粉末变红色,说明氧化铜发生了还原反应,因为铜元素由+2价降低到0价,B错误;C、硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应不仅仅生成水和二氧化碳,还生成了具有还原性的CO,C错误;D、甲烷不能与溴水反应,推知甲烷不能与卤素单质的水溶液反应,但是甲烷能与纯净的卤素单质在光照或高温下发生取代反应,D错误;答案选A;(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,说明甲烷与氯气在光照下生成了易溶于水的氯化氢气体,因此推断发生了取代反应,如CH4 + Cl2
7 Cu + CO2 + CO + 4 H2O;(3)浓硫酸具有吸水性,且不能与甲烷反应,因此实验甲中浓硫酸起干燥甲烷的作用;集气瓶是尾气处理装置,其中收集到的不溶于水的气体主要是CO,CO气体有毒,不能直接排入空气;(4)A、酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应,A正确;B、硬质试管里黑色粉末变红色,说明氧化铜发生了还原反应,因为铜元素由+2价降低到0价,B错误;C、硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应不仅仅生成水和二氧化碳,还生成了具有还原性的CO,C错误;D、甲烷不能与溴水反应,推知甲烷不能与卤素单质的水溶液反应,但是甲烷能与纯净的卤素单质在光照或高温下发生取代反应,D错误;答案选A;(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,说明甲烷与氯气在光照下生成了易溶于水的氯化氢气体,因此推断发生了取代反应,如CH4 + Cl2 ![]() CH3Cl + HCl;A、I瓶中气体颜色变浅,因为黄绿色的氯气逐渐消耗完全,A正确;B、I瓶中出现白雾,因为生成的氯化氢气体容易与水蒸气结合为盐酸小液滴,B正确;C、I瓶瓶内壁出现油状物质,因为甲烷与氯气发生取代反应,生成的一氯甲烷是气体,二氯甲烷、三氯甲烷、四氯化碳是油状液体,C正确;D、II瓶中与I瓶现象不相同,因为I有光照条件,能发生取代反应,II缺少光照条件,不能发生取代反应,D错误;答案选ABC。
CH3Cl + HCl;A、I瓶中气体颜色变浅,因为黄绿色的氯气逐渐消耗完全,A正确;B、I瓶中出现白雾,因为生成的氯化氢气体容易与水蒸气结合为盐酸小液滴,B正确;C、I瓶瓶内壁出现油状物质,因为甲烷与氯气发生取代反应,生成的一氯甲烷是气体,二氯甲烷、三氯甲烷、四氯化碳是油状液体,C正确;D、II瓶中与I瓶现象不相同,因为I有光照条件,能发生取代反应,II缺少光照条件,不能发生取代反应,D错误;答案选ABC。

【题目】化学与社会、生活、环境保护密切相关,下列现象或事实与解释一致的是
编号 | 现象或事实 | 解释 |
A | SiO2+Na2CO3 | 酸性:H2SiO3>H2CO3 |
B | 2Mg+CO2 | 还原性:Mg>C |
C | 漂白粉因在空气中放置时间过久而变质 | 漂白粉中的CaCl2与空气中的CO2反应生成碳酸钙 |
D | 利用氯化铁溶液可以制作铜质印刷线路板 | FeCl3溶液置换出铜单质 |
A. A B. B C. C D. D
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是
选项 | A | B | C | D |
实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 1 mol·L-1盐酸 | 用NaCl溶液制备氯化钠晶体 | 除去乙烯中少量SO2 |
实验仪器或装置 | 烧杯、玻璃 棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |
|
|
A. A B. B C. C D. D


