题目内容
在容积一定的密闭器中发生可逆反应A(g)+2B(g)2C(g)—Q,条件变化时,影响平衡移动的关系如图所示。下列说法正确的是( )
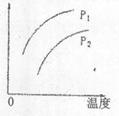
A.P1<P2,纵坐标指A的质量分数
B.P1>P2,纵坐标指C的质量分数
C.P1<P2,纵坐标指混合气体的平均摩尔质量
D.P1>P2,纵坐标指A的转化率
BD

练习册系列答案
相关题目
题目内容
在容积一定的密闭器中发生可逆反应A(g)+2B(g)2C(g)—Q,条件变化时,影响平衡移动的关系如图所示。下列说法正确的是( )

A.P1<P2,纵坐标指A的质量分数
B.P1>P2,纵坐标指C的质量分数
C.P1<P2,纵坐标指混合气体的平均摩尔质量
D.P1>P2,纵坐标指A的转化率
BD
