题目内容
把铁和氧化铁的混合物共15 g,加入到150 mL稀硫酸溶液中,标准状况下放出氢气体积为1.68 L,铁与氧化铁全部反应完毕,向溶液中加入少量的硫氰化钾溶液,无明显现象,为了中和过量的稀硫酸,并使生成的硫酸亚铁全部转化为氢氧化亚铁沉淀,用去3 mol/L的氢氧化钠溶液200 mL,则该稀硫酸的物质的量浓度为
- A.1.15 mol/L
- B.1 mol/L
- C.3 mol/L
- D.2 mol/L
B
解析:这5种物质和盐酸反应的方程式为:Zn+2HCl===ZnCl2+H2↑,ZnO+2HCl===ZnCl2+H2O,Zn(OH)2+2HCl===ZnCl2+2H2O,ZnCO3+2HCl===ZnCl2+H2O+CO2↑,ZnS+2HCl===ZnCl2+H2S↑.分析这5个化学方程式可知:相同物质的量的这5种物质和等浓度、等体积的适量盐酸反应后,生成的ZnCl2物质的量相同,生成的水的物质的量有三种情况:Zn和ZnS无水生成,ZnO和ZnCO3生成的水的量相同,Zn(OH)2生成的水的量最多.所以得到的溶液中ZnCl2的质量分数有3种情况,应选B.
解析:这5种物质和盐酸反应的方程式为:Zn+2HCl===ZnCl2+H2↑,ZnO+2HCl===ZnCl2+H2O,Zn(OH)2+2HCl===ZnCl2+2H2O,ZnCO3+2HCl===ZnCl2+H2O+CO2↑,ZnS+2HCl===ZnCl2+H2S↑.分析这5个化学方程式可知:相同物质的量的这5种物质和等浓度、等体积的适量盐酸反应后,生成的ZnCl2物质的量相同,生成的水的物质的量有三种情况:Zn和ZnS无水生成,ZnO和ZnCO3生成的水的量相同,Zn(OH)2生成的水的量最多.所以得到的溶液中ZnCl2的质量分数有3种情况,应选B.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
 某溶液中可能含有H+、Na+、
某溶液中可能含有H+、Na+、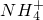 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、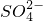 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、 某溶液中可能含有H+、Na+、
某溶液中可能含有H+、Na+、 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、 、Mg2+、Al3+
、Mg2+、Al3+