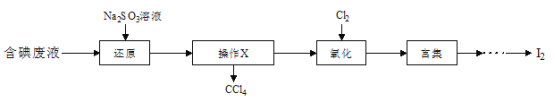
题目内容
【题目】下表是元素周期表的一部分.表中所列字母分别代表一种元素.

试回答下列问题:
(1)请画出元素D的基态原子的价电子排布图______________;与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有______________种;
(2)A的最简单氢化物的中心原子的杂化形式为______________;C在空气中燃烧产物的分子构型为______________,与其互为等电子体的单质的分子式为______________;
(3)B单质晶体中原子的堆积方式如图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

①晶胞中B原子的配位数为______________,其堆积方式______________(填“是或否”)密置堆积。②若B原子的半径为d cm,用NA表示阿伏加德罗常数,M表示B原子的相对原子质量,则该晶体的密度为______________(用字母表示)。
【答案】
(1)![]() ;8;
;8;
(2)sp3;V;O3;
(3)12;是;![]() g/cm3
g/cm3
【解析】
试题分析:根据元素在周期表中的位置知,A、B、C、D分别是C、Al、S、Mn元素。
(1)Mn原子3d、4s能级上分别含有5、2个电子,其价电子排布图为![]() ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有Ca、Sc、Ti、V、Fe、Co、Ni、Zn,所以有8种,故答案为:
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有Ca、Sc、Ti、V、Fe、Co、Ni、Zn,所以有8种,故答案为:![]() ;8;
;8;
(2)C元素的最简单氢化物是甲烷,甲烷分子中C原子价层电子对个数是4,根据价层电子对互斥理论知C原子杂化类型为sp3;S在空气中燃烧产物是二氧化硫,二氧化硫分子中S原子价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论得二氧化硫的分子构型为V形,原子个数相等、价电子数相等的微粒互为等电子体,与其互为等电子体的单质的分子式为O3,故答案为:sp3;V;O3;
(3)晶胞中Al原子的配位数=3×8÷2=12,其堆积方式是密置堆积,Al的原子半径为dcm,根据图知,每个面对角线上3个原子共线,则晶胞边长=2![]() dcm,晶胞体积=(2
dcm,晶胞体积=(2![]() d)3cm3该晶胞中原子个数=8×
d)3cm3该晶胞中原子个数=8×![]() +6×
+6×![]() =4,密度=
=4,密度=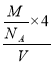 =
=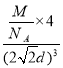 g/cm3=
g/cm3=![]() g/cm3,故答案为:12;是;
g/cm3,故答案为:12;是;![]() g/cm3。
g/cm3。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案