题目内容
在Na2SO4和Al2(SO4)3的混合溶液中,如果[SO42-]=0.3mol?L-1,当加入等体积的0.2mol/L的NaOH溶液时,生成沉淀恰好完全溶解,则原混合溶液中Na+ 物质的量浓度是
- A.0.5 mol/L
- B.0.3 mol/L
- C.0.45 mol/L
- D.0.225 mol/L
C
分析:当加入等体积的0.2mol/L的NaOH溶液时,生成沉淀恰好完全溶解,发生总反应为Al3++4OH-=AlO2-+2H2O,令溶液体积为1L,根据反应据此计算溶液中Al3+的物质的量,根据c= 计算原溶液中Al3+的浓度,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),据此计算原溶液中Na+ 物质的量浓度.
计算原溶液中Al3+的浓度,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),据此计算原溶液中Na+ 物质的量浓度.
解答:令溶液体积为1L,则氢氧化钠的物质的量为1L×0.2mol/L=0.2mol,根据反应Al3++4OH-=AlO2-+2H2O可知,原溶液中Al3+的物质的量为0.2mol×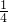 =0.05mol,原溶液中Al3+的浓度为
=0.05mol,原溶液中Al3+的浓度为 =0.05mol/L,
=0.05mol/L,
根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),
故c(Na+)=2c(SO42-)-3c(Al3+)=0.3mol/L×2-0.05mol/L×3=0.45mol/L,
故选C.
点评:考查溶液中离子浓度的计算等,难度不大,混合溶液中有关离子浓度的计算经常利用电荷守恒,注意守恒思想的运用.
分析:当加入等体积的0.2mol/L的NaOH溶液时,生成沉淀恰好完全溶解,发生总反应为Al3++4OH-=AlO2-+2H2O,令溶液体积为1L,根据反应据此计算溶液中Al3+的物质的量,根据c=
 计算原溶液中Al3+的浓度,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),据此计算原溶液中Na+ 物质的量浓度.
计算原溶液中Al3+的浓度,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),据此计算原溶液中Na+ 物质的量浓度.解答:令溶液体积为1L,则氢氧化钠的物质的量为1L×0.2mol/L=0.2mol,根据反应Al3++4OH-=AlO2-+2H2O可知,原溶液中Al3+的物质的量为0.2mol×
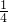 =0.05mol,原溶液中Al3+的浓度为
=0.05mol,原溶液中Al3+的浓度为 =0.05mol/L,
=0.05mol/L,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),
故c(Na+)=2c(SO42-)-3c(Al3+)=0.3mol/L×2-0.05mol/L×3=0.45mol/L,
故选C.
点评:考查溶液中离子浓度的计算等,难度不大,混合溶液中有关离子浓度的计算经常利用电荷守恒,注意守恒思想的运用.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:

(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式: ;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Zn(OH)2 |
|
开始沉淀pH |
2.3 |
4.0 |
5.6 |
|
完全沉淀pH |
4.1 |
5.2 |
8.0 |
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为 (写化学式),III中加入MnO2的作用是 ;
(3)Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水)如图,则IV中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 ;

(4)V是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为 ;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO2、ZnCO3、MnCO3、 和 (写化学式)。

