题目内容
(12分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是____________。
(2)用离子方程式表示A的水溶液显碱性的原因______________________________。
(3)25 ℃时pH=9的A溶液和pH=9的C溶液中水的电离程度较小的是________(填写A或C的化学式)。
(4)25 ℃时用惰性电极电解D的水溶液,一段时间后溶液的pH________7(填“>”、“<”或“=”)。
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________________________________________。
(6)室温时在一定体积0.2 mol·L-1的C溶液中,加入一定体积的0.1 mol·L-1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________。
| 阳离子 | Na+、Ba2+、NH4+、K+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是____________。
(2)用离子方程式表示A的水溶液显碱性的原因______________________________。
(3)25 ℃时pH=9的A溶液和pH=9的C溶液中水的电离程度较小的是________(填写A或C的化学式)。
(4)25 ℃时用惰性电极电解D的水溶液,一段时间后溶液的pH________7(填“>”、“<”或“=”)。
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________________________________________。
(6)室温时在一定体积0.2 mol·L-1的C溶液中,加入一定体积的0.1 mol·L-1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________。
(12分)(1)醋酸钾 (2)CH3COO-+H2O CH3COOH+OH- (3)Ba(OH)2 (4)=
CH3COOH+OH- (3)Ba(OH)2 (4)=
(5)c(OH-)>c(Ba2+)=c(Cl-)>c(NH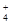 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH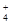 )>c(H+) (6)2∶3
)>c(H+) (6)2∶3
 CH3COOH+OH- (3)Ba(OH)2 (4)=
CH3COOH+OH- (3)Ba(OH)2 (4)=(5)c(OH-)>c(Ba2+)=c(Cl-)>c(NH
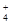 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH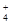 )>c(H+) (6)2∶3
)>c(H+) (6)2∶3试题分析:(1)D溶液焰色反应显黄色,说明含有Na+。C溶液和D溶液相遇时只生成白色沉淀,则白色沉淀是硫酸钡,因此D是硫酸钠。B溶液和C溶液相遇时只生成有刺激性气味的气体,则该气体是氨气。又因为A、C溶液的pH均大于7,B溶液的pH小于7,所以B是氯化铵,则C氢氧化钡,A就是醋酸钾。
(2)醋酸钾是强酸弱碱盐,水解显碱性,即CH3COO-+H2O
 CH3COOH+OH-。
CH3COOH+OH-。(3)醋酸钾水解促进水的电离,氢氧化钡是强碱,抑制水的电离,所以溶液中水的电离程度较小的是Ba(OH)2。
(4)惰性电极电解硫酸钠溶液,则实质是电解水,溶液始终显中性,即pH=7。
(5)等体积、等物质的量浓度的B溶液和C溶液混合后,氢氧化钡过量,因此反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH
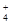 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH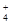 )>c(H+)。
)>c(H+)。(6)混合溶液的pH=13,即OH-的浓度是0.1mol/L。这说明氢氧化钡是过量的,则
 ,解得
,解得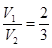 。
。点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,难易适中、注重考查学生分析问题、以及灵活运用基础知识解决问题的能力。有助于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目