��Ŀ����
����Ŀ��Ԫ���ǹ������������������һ�����ʵġ�ԭ���ϡ���
��1����18������������ѧ���Dz���̽��Ԫ��֮�գ�ͨ���Ӿֲ���ϵͳ���о����̣�������Ԫ��֮���������ϵ�������г��˼�λ�ܳ���ѧ�ҵ��о�������
��� | �� | �� | �� | �� |
��ѧ�� | Ŧ���� | ������ | �±����� | �йŶ��� |
���� | ���֡������ɡ���ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ� | ���� ����ԭ���ۣ����ȿ�ʼ���ԭ�������IJⶨ���� | ������5���������Ƶġ���Ԫ���顱���м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ | ��Ϊ ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳���� |
������ѧ�ҵ��о�����ʱ���Ⱥ����������������������ţ���
��2��1869�꣬�Ž��з���ǰ���о��Ļ������Ƴ��˵�һ��Ԫ�����ڱ�����ͼ1��ʾ�� 
���Ž��з�����Ԫ�ذ������ԭ����������ͬһ������С������С���Ԫ���������ƣ���ϱ�����Ϣ�������4�з����С���=70�����ʺű���ĺ����� �� ��5�з����С�Te=128�������ʺű���ĺ����� ��
�ڵ�20���ͳ����Ž��з����ڱ���Ϊδ֪Ԫ�����µĿ�λ�����������ң�����ԭ�ӽṹ�����أ���ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ����������ĸ��ţ���
A�����ź˵����������ԭ�Ӻ�������Ų����������Ա仯
B�����ź˵����������ԭ�Ӱ뾶���������Ա仯
C�����ź˵����������Ԫ����������ϼ۳��������Ա仯
��3�������е�Ԫ�����ڱ�����A,B,D,E,X��Y��Z���ֶ�����Ԫ�أ�X��Y����ͬһ���ڣ�Y������������ˮ������ǿ�ᡢǿ����ܷ�Ӧ��Z�ĵ��ʳ�����Ϊ��̬��ͬ������������������ܶȱ�Ϊ35.5��������Ϣ��ͼ2��ʾ�� ����������Ԫ���У����ڵڶ����ڵ�������Ԫ�ط��ű�ʾ����ͬ����X�����ڱ��е�λ���� ��
��E��ԭ�ӽṹʾ��ͼΪ �� д��ZԪ����̬�⻯��ĵ���ʽ�� ��
��B������E������������ˮ������һ�������·�����Ӧ�Ļ�ѧ����ʽΪ��Y������X������������ˮ������Һ��Ӧ�����ӷ���ʽΪ ��
��B��D������������ˮ����Ļ�ѧʽ�ֱ�Ϊ�� �� ��������ǰ�����ǿ�ڡ������ڡ������ߣ�ԭ����B��D�ķǽ������в��죬����ԭ�ӽṹ���Ͳ��������ԭ�� ��
���𰸡�
��1���ڢۢܢ�
��2�����У����ԭ������Ϊ70��Ԫ�أ�����Te�����ԭ����������128��A
��3��C��N���������ڣ��ڢ�A�壻![]() ��
��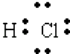 ��C+2H2SO4��Ũ��
��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2����H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C
CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2����H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C
���������⣺��1��1865�꣬Ŧ���ȷ��֡������ɡ���ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ���1803�꣬�����ٴ��� ����ԭ���ۣ����ȿ�ʼ���ԭ�������IJⶨ������1829�꣬�±����ɷ�����5���������Ƶġ���Ԫ���顱���м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ��1862�꣬�йŶ�����Ϊ ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳��������������ѧ�ҵ��о�����ʱ���Ⱥ�����������Ǣڢۢܢ٣����Դ��ǣ��ڢۢܢ٣���2���ٽ�ϱ�����Ϣ�ã���������Ԫ�ص����ԭ����������ͬһ����Ԫ���������ƣ���ϱ�����Ϣ�������4�з����С���=70�����ʺű���ĺ��������ԭ������Ϊ70��Ԫ�أ���Te=128��������Te�����ԭ����������128���ʵ�5�з����С�Te=128�������ʺű���ĺ����ǻ���Te�����ԭ����������128�����Դ��ǣ����У����ԭ������Ϊ70��Ԫ�أ�����Te�����ԭ����������128���ڿ�ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ�������ź˵����������ԭ�Ӻ�������Ų����������Ա仯�����Դ��ǣ�A����3��Y������������ˮ������ǿ�ᡢǿ����ܷ�Ӧ����Y������Ԫ�����Ƕ�����Ԫ�أ���YΪAl��X��Y����ͬһ���ڣ���XΪ��������Ԫ�أ���X�����1�����ӣ���XΪNa��Z�ĵ��ʳ�����Ϊ��̬��ͬ������������������ܶȱ�Ϊ35.5����ZΪCl��ͬһ���ڴ����ң��뾶���μ�С����B��DΪ�ڶ�����Ԫ�أ�EΪ��������Ԫ�أ�B�����4�����ӣ���BΪC��D�����5�����ӣ���DΪN��E�����6�����ӣ���EΪS���ݴ˽��з���������������Ԫ���У����ڵڶ����ڵ���C��N��XΪNa�������ڱ��е�λ���ǵ������ڣ��ڢ�A�壻���Դ��ǣ�C��N���������ڣ��ڢ�A�壻��EΪS����ԭ�ӽṹʾ��ͼΪ ![]() ��ZΪCl������̬�⻯��ΪHCl��HCl��������1����ԭ�Ӻ�1����ԭ��ͨ������1�Ե��ӽ�϶��ɵĹ��ۻ����������ʽΪ
��ZΪCl������̬�⻯��ΪHCl��HCl��������1����ԭ�Ӻ�1����ԭ��ͨ������1�Ե��ӽ�϶��ɵĹ��ۻ����������ʽΪ 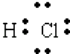 �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� 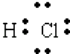 ����BΪC��E������������ˮ����ΪH2SO4 �� ��Ӧ���ɶ�����̼�����������ˮ���ʻ�ѧ����ʽΪC+2H2SO4��Ũ��
����BΪC��E������������ˮ����ΪH2SO4 �� ��Ӧ���ɶ�����̼�����������ˮ���ʻ�ѧ����ʽΪC+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O�� YΪAl��X������������ˮ����ΪNaOH����Ӧ����ƫ�����ƺ�ˮ���ʻ�ѧ����ʽΪ2Al+2H2O+2NaOH�T2NaAlO2+3H2������ǿ�ᣬǿ�������β𣬹����ӷ���ʽΪ2Al+2H2O+2OH���T2AlO2��+3H2�������Դ��ǣ�C+2H2SO4��Ũ��
CO2��+2SO2��+2H2O�� YΪAl��X������������ˮ����ΪNaOH����Ӧ����ƫ�����ƺ�ˮ���ʻ�ѧ����ʽΪ2Al+2H2O+2NaOH�T2NaAlO2+3H2������ǿ�ᣬǿ�������β𣬹����ӷ���ʽΪ2Al+2H2O+2OH���T2AlO2��+3H2�������Դ��ǣ�C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2������B��D������������ˮ����Ļ�ѧʽ�ֱ�ΪH2CO3��HNO3��̼�����Ա���������B��D�ķǽ������в��죬ԭ����Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C�����Դ��ǣ�H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C��
CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2������B��D������������ˮ����Ļ�ѧʽ�ֱ�ΪH2CO3��HNO3��̼�����Ա���������B��D�ķǽ������в��죬ԭ����Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C�����Դ��ǣ�H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C��

 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�����Ŀ����ΪԪ�����ڱ���һ���֣����û�ѧ����ش��й����⣺
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | �� |
��1���ٺ͢��Ԫ�ط���������
��2��Ԫ�آ��γɵ��⻯��ĵ���ʽ����
��3���������γ��������������Ԫ��������дԪ�ط��ţ�����д����Ԫ�ص����������������������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ ��