题目内容
在盛有水的电解槽中加入等物质的量的AgNO3、Ba(NO3)2、Na2SO4、MgCl2,摇匀后用惰性电极电解,最初得到的氧化产物与还原产物的质量比为( )
| A.71:2 | B.71:216 | C.8:1 | D.16:137 |
A
由于Ag++Cl-="AgCl↓" Ba2++SO42-=BaSO4↓反应,最终溶液中离子为NO3-、SO42-、Na+、Mg2+、Cl-
阴极电极反应为:2H++2e-=H2↑ 阳极电极反应为:2Cl--2e-=Cl2↑
最初得到的氧化产物Cl2与还原产物H2的质量比为71:2,答案为A
阴极电极反应为:2H++2e-=H2↑ 阳极电极反应为:2Cl--2e-=Cl2↑
最初得到的氧化产物Cl2与还原产物H2的质量比为71:2,答案为A

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
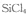 也可转化为
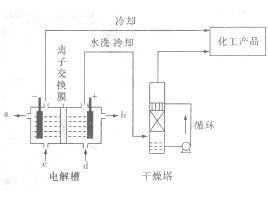
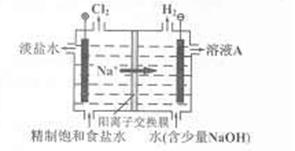
也可转化为 而循环使用。一定条件下,在200C恒容密闭容器中发生反应:
而循环使用。一定条件下,在200C恒容密闭容器中发生反应: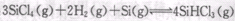 ,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。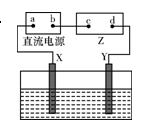
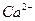 、
、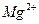 ,NH+3,
,NH+3,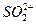 ,[
,[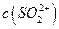 >
>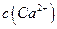 ]。
]。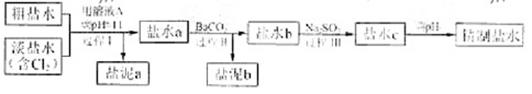
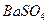 的溶解度比
的溶解度比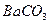 的小,过程Ⅱ中除去的离子有
的小,过程Ⅱ中除去的离子有 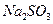 的含量小于5mg /l ,若盐水b中
的含量小于5mg /l ,若盐水b中 的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10%
的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10% 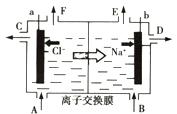
 路中通过电子的物质的量是
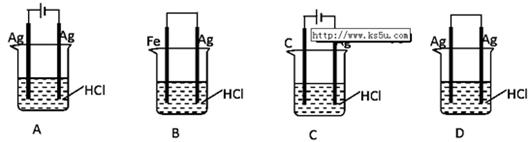
路中通过电子的物质的量是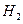 ↑反应,设计了下列四个实验如图所示。你认为可行的是 ( )
↑反应,设计了下列四个实验如图所示。你认为可行的是 ( )