题目内容
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
| A.将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2mL |
| B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg |
| C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg |
| D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重dg |
D
解析试题分析:D中想通过测生成的SO2的质量得亚硫酸钠,从而得出其质量分数,但不能保证生成的二氧化硫全部被碱石灰吸收,有部分二氧化硫留在装置中,故测得结果不准确,D项不合理;故选D;A、Na2SO3与高锰酸钾发生氧化还原,通过高锰酸钾的量求出亚硫酸钠的量,从而求得亚硫酸钠的质量分数,故A正确;B、H2O2把亚硫酸钠氧化成硫酸钠,加入足量BaCl2溶液把硫酸根全部转化成沉淀,通过测沉淀的质量得出硫酸钡的物质的量,根据原子守恒,硫酸钡的物质的量等于亚硫酸钠和硫酸钠的物质的量之和,根据两者总物质的量和总质量可求得亚硫酸钠的质量分数;C、盐酸把亚硫酸钠反应掉,氯化钡与硫酸钠反应转化成硫酸钡沉淀,求出硫酸钠的量,再求出亚硫酸钠,故C正确;故选D。
考点:考查亚硫酸钠的还原性、实验过程的分析能力等

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )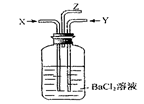
A.洗气瓶中产生的沉淀是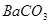 |
B.在Z导管出来的气体中无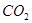 |
C.洗气瓶中产生的沉淀是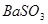 |
| D.在Z导管口有红棕色气体出现 |
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下面化学反应不符合绿色化学概念的是
| A.消除硫酸厂尾气排放:SO2+2NH3 = (NH4)2SO3 |
| B.消除制硝酸工业尾气排放:NO2+NO+2NaOH =2NaNO2+H2O |
| C.制CuSO4:Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O |
| D.制CuSO4:2Cu+O2= 2CuO CuO+H2SO4(稀) = CuSO4+H2O |
(双选)将下列物质加入溴水中,溴水颜色不变浅的是( )。
| A.KCl晶体 | B.KI晶体 | C.CCl4 | D.Mg |
下列叙述正确的是( )
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2 |
| C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法中,正确的是( )
| A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 |
| B.将二氧化碳通入硅酸钠溶液可以得到硅酸 |
| C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
| D.二氧化硅是酸性氧化物,它不溶于任何酸 |
实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法中不正确的是( )
| A.由题目信息知:KMnO4的氧化性比MnO2的强 |
| B.制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 |
| C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 |
| D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是 ( )。
| A.青石棉是一种易燃品且易溶于水 |
| B.青石棉的化学组成用氧化物的形式可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O |
| C.1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol·L-1的硝酸 |
| D.Na2Fe5Si8O22(OH)2能与氢氟酸作用 |