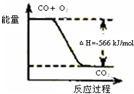
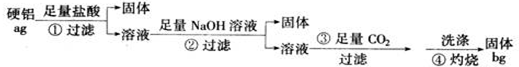
题目内容
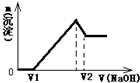
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是( )
A.恰好溶解后溶液中的NO3-离子的物质的量为
| ||||
B.反应过程中转移的电子数为
| ||||
C.生成NO气体的体积为
| ||||
D.与合金反应反应的硝酸的物质的量为(
|
A、当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO3),硝酸根离子与钠离子的物质的量相等,n(NO3-)=n(Na+)=n(NaOH)=
mol,故A正确;
B、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=
mol,故B正确;
C、根据电子守恒原理,生成NO时是HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即
×
=
mol,其体积在标准状况下为为
L,但是选项中没有说明状态,则此时的体积不能确定,故C错误;
D、参加反应的硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
mol,作氧化剂的硝酸的物质的量等于NO的物质的量,即
mol,所以与合金反应的硝酸的物质的量为(
+
)mol,故D正确.
故选C.
| bv |
| 1000 |
B、至沉淀量最大,生成的n克沉淀为氢氧化铝和氢氧化镁.根据质量守恒定律,其中镁、铝元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Al3+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=
| n-m |
| 17 |
C、根据电子守恒原理,生成NO时是HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即
| n-m |
| 17 |
| 1 |
| 3 |
| n-m |
| 51 |
| 22.4(n-m) |
| 51 |
D、参加反应的硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
| bv |
| 1000 |
| n-m |
| 51 |
| n-m |
| 51 |
| bv |
| 1000 |
故选C.

练习册系列答案
相关题目