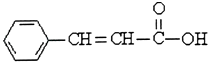��Ŀ����
����Ŀ����֪NaHSO4��ˮ��Һ�еĵ��뷽��ʽΪNaHSO4=Na++H++SO ![]() ��ij�¶��£���pH=6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2�����ڸ���Һ��������������ȷ���ǣ� ��
��ij�¶��£���pH=6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2�����ڸ���Һ��������������ȷ���ǣ� ��
A.���¶ȸ���25��
B.��ˮ�������c��H+��=1��10��12 molL��1
C.c��H+��=c��OH����+c��SO42����
D.���¶��¼�������pHΪ12��NaOH��Һ����ʹ��Ӧ�����Һǡ�ó�����
���𰸡�BD
���������⣺A.25��ʱpH=7��pH=6˵���ٽ���ˮ�ĵ��룬��T��25�棬��A��ȷ��B������ҺΪǿ����Һ��������Ũ��Ϊ0.01mol/L��������������Ũ��= ![]() mol/L=10��10molL��1 �� ����Һ��ˮ�������������Ũ�ȵ�������������Ũ��10��10molL��1 �� ��B����
mol/L=10��10molL��1 �� ����Һ��ˮ�������������Ũ�ȵ�������������Ũ��10��10molL��1 �� ��B����
C����������������Һ�еĵ���غ�ã�c��H+��+c��Na+��=c��OH����+2c��SO ![]() �������������غ��c��Na+��=c��SO
�������������غ��c��Na+��=c��SO ![]() �������Ե�c��H+��=c��OH����+c��SO42��������C��ȷ��
�������Ե�c��H+��=c��OH����+c��SO42��������C��ȷ��
D��c��NaHSO4��0.01mol/L�����¶���pHΪ12��NaOH��Һ��c��NaOH��=1mol/L�����ߵ������ϣ���Һ�ʼ��ԣ���D����
��ѡBD��

��ϰ��ϵ�д�
�����Ŀ