题目内容
硫酸亚铁晶体在医药上作补血剂.某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是:Fe2++MnO4-+H+--Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管.
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,e.稀硫酸,f.稀盐酸,g.蒸馏水.
[实验步骤]
①称取0.474g KMnO4晶体,配成250.00mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500g),研细后加稀硫酸溶解,配成100.00mL水溶液.
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中.
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数.
⑤滴定,并记录KMnO4标准溶液的终读数.再重复滴定2次.
[实验记录]
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
(1)准备的实验用品中,不需要的仪器有(填序号)______;不需要的试剂有(填序号)______.
(2)本实验所用的KMnO4标准溶液的物质的量浓度为______.
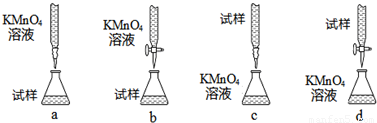
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是______(填字母序号).
(4)判断滴定终点的依据是______.
(5)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量会______(偏大、偏小、无影响).
(6)根据实验数据,计算该补血剂中铁元素的含量______.
【答案】分析:(1)配制一定物质的量浓度的KMnO4溶液,所用的仪器根据实验步骤来选择;在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,测定Fe2+的含量,实验时不能用盐酸酸化,因为盐酸与高锰酸钾发生氧化还原反应,应用硫酸酸化,高锰酸钾本身呈紫色,无需指示剂,不用酚酞和KSCN溶液;
(2)根据物质的量浓度的计算公式计算;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察;
(4)滴定终点时,颜色变成紫红色,并且半分钟内不褪色;
(5)配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,以此计算.
解答:解:(1)配制一定物质的量浓度的KMnO4溶液,所用的仪器根据实验步骤来选择,①称量,用到电子天平、药匙,②溶解,用到烧杯、玻璃棒,③移液,用到玻璃棒、250ml容量瓶,④洗涤,⑤定容,用到胶头滴管等,所以不需要的仪器有c.100mL量筒,e.漏斗,g.锥形瓶;
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,测定Fe2+的含量,实验时不能用盐酸酸化,因为盐酸与高锰酸钾发生氧化还原反应,应用硫酸酸化,高锰酸钾本身呈紫色,无需指示剂,不用酚酞和KSCN溶液,故答案为:c,e,j;c,d,f;
(2)KMnO4标准溶液的物质的量浓度为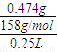 =1.200×10-2 mol?L-1,故答案为:1.200×10-2 mol?L-1;
=1.200×10-2 mol?L-1,故答案为:1.200×10-2 mol?L-1;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,
故答案为:b;
(4)滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点,故答案为:滴入最后一滴KMnO4溶液恰好由黄绿色变浅紫红色,且半分钟内不褪色;
(5)加入水冲洗的目的是将锥形瓶壁上的残留待测液完全反应,避免产生误差,加入水无影响,本操作为正确操作,故答案为:无影响;
(6)配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,
反应需要的高锰酸钾的物质的量为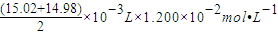 =18×10-5mol
=18×10-5mol
则:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 18×10-5mol
n=18×10-5mol×5=90×10-5mol,
则1.500g硫酸亚铁补血剂药片含铁的质量为90×10-5mol×5×56g/mol=0.252g,所以该补血剂中铁元素的含量为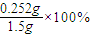 =16.8%,
=16.8%,
故答案为:16.8%.
点评:本题综合考查铁的含量的测定,题目难度较大,做题时注意滴定数据,排除误差较大的一组.
(2)根据物质的量浓度的计算公式计算;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察;
(4)滴定终点时,颜色变成紫红色,并且半分钟内不褪色;
(5)配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,以此计算.
解答:解:(1)配制一定物质的量浓度的KMnO4溶液,所用的仪器根据实验步骤来选择,①称量,用到电子天平、药匙,②溶解,用到烧杯、玻璃棒,③移液,用到玻璃棒、250ml容量瓶,④洗涤,⑤定容,用到胶头滴管等,所以不需要的仪器有c.100mL量筒,e.漏斗,g.锥形瓶;
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,测定Fe2+的含量,实验时不能用盐酸酸化,因为盐酸与高锰酸钾发生氧化还原反应,应用硫酸酸化,高锰酸钾本身呈紫色,无需指示剂,不用酚酞和KSCN溶液,故答案为:c,e,j;c,d,f;
(2)KMnO4标准溶液的物质的量浓度为
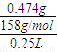 =1.200×10-2 mol?L-1,故答案为:1.200×10-2 mol?L-1;
=1.200×10-2 mol?L-1,故答案为:1.200×10-2 mol?L-1;(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,
故答案为:b;
(4)滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点,故答案为:滴入最后一滴KMnO4溶液恰好由黄绿色变浅紫红色,且半分钟内不褪色;
(5)加入水冲洗的目的是将锥形瓶壁上的残留待测液完全反应,避免产生误差,加入水无影响,本操作为正确操作,故答案为:无影响;
(6)配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,
反应需要的高锰酸钾的物质的量为
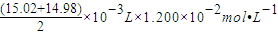 =18×10-5mol
=18×10-5mol则:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 18×10-5mol
n=18×10-5mol×5=90×10-5mol,
则1.500g硫酸亚铁补血剂药片含铁的质量为90×10-5mol×5×56g/mol=0.252g,所以该补血剂中铁元素的含量为
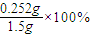 =16.8%,
=16.8%,故答案为:16.8%.
点评:本题综合考查铁的含量的测定,题目难度较大,做题时注意滴定数据,排除误差较大的一组.

练习册系列答案
相关题目




