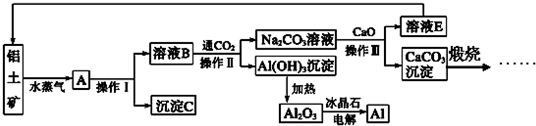
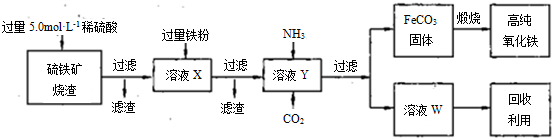
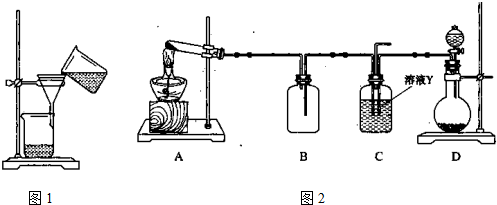
题目内容
实验室有CaCO3和KHCO3组成的混合物试样。化学兴趣小组的高三同学指导高一同学利用其进行了有益的探究和思维品质训练。请你也参加讨论。称取上述混合物20.0 g与2 mol·L-1盐酸160.0 mL充分反应。
(1)若混合物中,n(CaCO3)=n(KHCO3),则可生成的气体的体积(标准状况)为____________L。
(2)若混合物中,n(CaCO3)≠n(KHCO3),则所生成的气体的物质的量可能是____________(填序号)。
A.0.22 mol B.0.20 mol C.0.18 mol D.0.16 mol
结合简单计算和推理,简要说明不作出相关选项选择的理由分别是_____________________;_____________________。
(1)4.48 (2)BC
M(CaCO3)=M(KHCO3)=100 g·mol-1,20.0 g混合物的物质的量为0.20 mol。最多生成n(CO2)=0.20 mol,故不选A 20.0 g试样若全为CaCO3,则生成CO2的量最少,应以n(HCl)计算,为0.16 mol,故不选D
解析:M(CaCO3)=M(KHCO3)=100 g·mol-1,则20.0 g混合物为0.2 mol。
n(HCl)=2 mol·L-1×0.16 L=0.32 mol
由反应CaCO3+2HCl====CaCl2+H2O+CO2↑和KHCO3+HCl====KCl+H2O+CO2↑,可知若样品全部为CaCO3时,HCl不足量,而全部为KHCO3时,HCl有剩余,当n(CaCO3)=n(KHCO3)=0.1 mol时,HCl剩余0.02 mol,混合物完全反应,应生成n(CO2)=0.2 mol,即4.48 L。当n(CaCO3)≠n(KHCO3)时,如上所述,若全部为CaCO3,应根据n(HCl)计算CO2,n(CO2)=0.16 mol,故不能选。由于n(混合物)=0.2 mol,故最多可生成CO2 0.2 mol,A不能选。

 现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象.
现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象. 现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为
现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为 现象:有气泡产生,有关反应的离子方程式为
现象:有气泡产生,有关反应的离子方程式为