题目内容
【题目】前四周期元素A、B、C、D、E、F,原子序数依次递增。已知:A、B、D、C的价电子数依次增多,其中C元素的原子半径最小;A有两个单电子,E的未成对电子数是前四周期中最多的,且其外围电子数与D相同,F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:__________________________________________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)_____________________, 键角约为_____________________________________。
(3)下列物质的性质与氢键有关的是__________________________________________
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB-形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB-形成配位键,则E3+的配位数为________,1mol该配离子中含有_____________molσ 键。
(5)在C和D形成的化合物中,中心原子没有孤电子对的分子的空间构型为__________。
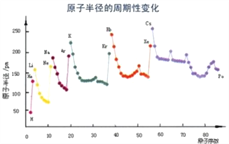
(6)根据下列图片说明为什么同周期过渡金属第一电离能变化没有主族元素变化明显__________________________________________。

(7)F与D形成的化合物晶胞如图,F的配位数为_____________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为__________________pm。(1pm=10-10cm)

【答案】 3d54s1 C2H4 120° A 6 12 正八面体 同周期过渡金属从左到右原子半径变化缓慢,原子核对外层电子的吸引力变化不大,所以第一电离能没有主族元素变化明显 4 ![]()
【解析】本题考查物质结构知识的运用,F的最外层电子数为2,内层全部排满,推出F为Zn,A有两个单电子,推出A可能是C或Si,根据问题(2),则A为C,E的未成对电子数是前四周期中最多的,因此E为Cr,E的外围电子为6,则D的外围电子也为6,D为O或S,几种元素原子序数依次递增,且A、B、D、C的价电子数依次增多,因此B为N,C为F,D为S,(1)Cr为过渡元素,价电子包括最外层电子和次外层d能级电子,即价电子排布式为:3d54s1;(2)A采取sp2杂化,说明C原子上有双键,因为分子量最小,因此化合物是C2H4,空间属于平面结构,即键角为120°;(3)A、可燃冰是由甲烷和水分子组成,其中水分子通过氢键,形成“笼”,“笼”中填充甲烷,故A正确;B、A的氢化物是烃,烃中不含氢键,故B错误;C、氢键影响物质的物理性质,而热稳定性是物质化学性质,故C错误;(4)Cr3+以d2sp3方式杂化,杂化轨道数为6,杂化轨道全部用来与CN-形成配位键,即Cr3+的配位数为6,1molCN-中含有1molσ键,Cr3+和CN-构成的配离子是[Cr(CN)6]3-,因此1mol[Cr(CN)6]3-含有σ键的物质的量为(6+6)mol=12mol;(5)S和F形成的化合物,因为F的电负性强于S,因此S为中心原子,没有孤电子对,此化合物为SF6,S的价层电子对数为6,即空间构型为正八面体;(6)同周期过渡金属从左到右原子半径变化缓慢,原子核对外层电子的吸引力变化不大,所以第一电离能没有主族元素变化明显;(7)灰球占有顶点和面心,个数为8×1/8+6×1/2=4,黑球位于内部,有4个,因此化学式为ZnS,根据晶胞,Zn的配位数为4,晶胞的质量为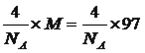 g,边长为xcm,晶胞的体积为x3,根据密度的定义,得出x=
g,边长为xcm,晶胞的体积为x3,根据密度的定义,得出x= 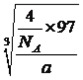 cm,合
cm,合![]() pm。
pm。