题目内容
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
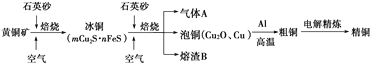
(1)气体A中的大气污染物可选用下列试剂中的________吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,检验溶液中还存在Fe2+的方法是________________________(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 ________________________________
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________.
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
【答案】 cd 取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去 3Cu2O+2Al![]() Al2O3+6Cu bd
Al2O3+6Cu bd
【解析】由流程可知,黄铜矿加入石英砂通入空气焙烧,可生成Cu2S、CuO,继续加入石英砂通入空气焙烧,生成Cu2O、Cu,生成气体A为二氧化硫,熔渣B为FeO等,Cu2O、Cu与铝在高温下发生铝热反应得到粗铜,电解可得到精铜,则
(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,a、浓H2SO4不能吸收二氧化硫,a错误;b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,b错误;c、NaOH溶液与二氧化硫反应生成亚硫酸钠,c正确;d、氨水与二氧化硫反应生成亚硫酸铵,d正确;答案选cd;(2)Fe2+具有还原性,可以利用KMnO4溶液检验,即取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去;(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al![]() Al2O3+6Cu;(4)a、反应中有热能产生,a错误;b、精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应,b正确;c、溶液中Cu2+向阴极移动,c错误;d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,d正确;答案选bd。
Al2O3+6Cu;(4)a、反应中有热能产生,a错误;b、精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应,b正确;c、溶液中Cu2+向阴极移动,c错误;d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,d正确;答案选bd。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
【题目】表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中能形成两性氧化物的元素所形成的单质与⑨最高价氧化物的水化物反应的离子方程式 .
(2)用电子式表示④元素与⑦元素形成的化合物形成过程 .
(3)③⑥⑦三种元素原子半径由小到大的顺序是(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是 .
(5)表中用于半导体材料的元素在元素周期表中的位置为 .



