题目内容
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为______________,G的原子结构示意图是___________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为____________________,所含化学键类型为_____________________________________。向甲中滴加足量水时发生反应的化学方程式是________________________________。
(3)E、F、G形成的简单离子,半径由大到小顺序是____________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,负极的电极反应式为_______________________________
【答案】 第二周期ⅤA族 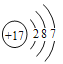
![]() 离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O==4NaOH+O2↑ S2->Cl->Na+ CH4 -8e- + 10OH- = CO32- + 7H2O
离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O==4NaOH+O2↑ S2->Cl->Na+ CH4 -8e- + 10OH- = CO32- + 7H2O
【解析】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增,A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素,则
(1)C是氮元素,原子有2个电子层,最外层电子数为5,在元素周期表中的位置:第2周期第VA族;氯原子的原子序数是17,因此Cl的原子结构示意图是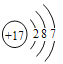 ;(2)D与E按原子个数比1:1形成化合物甲为Na2O2,其电子式为
;(2)D与E按原子个数比1:1形成化合物甲为Na2O2,其电子式为![]() ,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O==4NaOH+O2↑;(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+;(4)用CH4、O2和NaOH的水溶液组成燃料电池,电极材料为多孔惰性金属电极,在a极通入CH4气体,b极通入O2气体,甲烷发生氧化反应,则a极是该电池的负极,b为正极,氧气在正极获得电子,碱性条件下生成氢氧根离子,甲烷失去电子,因此负极的电极反应式为:CH4 -8e- + 10OH- = CO32- + 7H2O。
,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O==4NaOH+O2↑;(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+;(4)用CH4、O2和NaOH的水溶液组成燃料电池,电极材料为多孔惰性金属电极,在a极通入CH4气体,b极通入O2气体,甲烷发生氧化反应,则a极是该电池的负极,b为正极,氧气在正极获得电子,碱性条件下生成氢氧根离子,甲烷失去电子,因此负极的电极反应式为:CH4 -8e- + 10OH- = CO32- + 7H2O。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案