题目内容
下列关于反应过程中能量变化的说法正确的是 ( )
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
D
解析试题分析:A、催化剂只改变反应速率,不改变化学平衡,不改变反应的反应热,故A错误;B、①C(s)+O2(g)=CO2(g),△H1;②C(s)+1/2O2(g)=CO(g),△H2;③CO(g)+1/2O2(g)=CO2(g),△H3;由盖斯定理知①=②+③;又反应均为放热反应△H<0,故ΔH1<ΔH2,故B错误;C、反应热取决于反应物总能量和生成物总能量的大小关系,与反应的条件无关,故C错误;D、根据△H=正反应活化能-逆反应活化能=100kJ·mol-1,故D正确。
考点:反应热和焓变;盖斯定理的计算;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ② 生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
| A.①②③④ | B.②③⑤⑦⑧ | C.⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
下列叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。对该反应的有关叙述正确的是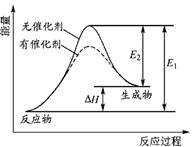
| A.该反应的正反应为吸热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂不能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
下列说法中,正确的是
| A.放热反应不需要加热就可以发生 |
| B.化学反应除了生成新物质外,还伴随着能量的变化 |
| C.反应条件为加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于反应条件 |
已知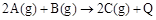 。下列说法或表达正确的是
。下列说法或表达正确的是
| A.使用催化剂可改变该反应的反应热 |
B.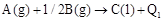 ; ;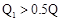 |
C.A和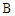 混合气体的稳定性比C气体强 混合气体的稳定性比C气体强 |
| D.该条件下,2LC气体分解成2LA气体与1LB气体吸收的热量为Q |
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496 kJ,水蒸气1molH-O键形成时放出热量463 kJ,则氢气中1molH-H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
下列说法正确的是
| A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol |
| B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为 —285.8kJ/mol |
| C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D.在稀溶液中:H+(aq) + OH--(aq) ="==" H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |