题目内容
【题目】A2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后A2O82-离子变为AO42-离子,又知反应中氧化剂和还原剂的物质的量之比为2︰1,Mn2+离子被氧化后Mn元素的化合价为
A. 4 B. 5 C. 6 D. 7
【答案】C
【解析】
根据元素的化合价变化结合电子得失守恒解答。
假设A2O82-中氧元素的化学价为-2,则A元素的化合价是+7价,AO42-中A元素的化合价是+6价,则A元素化合价降低1价,Mn2+是还原剂,设Mn元素的化合价升高到+x价,则根据得失电子守恒有:2×1×2=1×(x-2),得x=6,故答案选C。

【题目】活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2min内,用NO表示该反应的平均速率v(NO)=molL﹣1min﹣1 .
(2)该反应的化学方程式是 .
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 .
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是 , 电极反应式为:;
②b处电极反应式为;
③电池工作时H+由极移向极(填正、负极).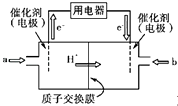
【题目】根据下列实验操作和现象,所得结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中含有SO |
B | 将蘸有浓氨水的玻璃棒靠近蘸有某溶液的玻璃棒 | 有白烟产生 | 该溶液是浓盐酸 |
C | 将某气体通入品红溶液中 | 溶液红色褪去 | 该气体可能是SO2 |
D | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中不含NH |
A.A
B.B
C.C
D.D