题目内容
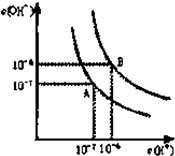
水的电离平衡曲线如图所示.
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从______增加到______.(填写具体数值)
(2)在25℃时将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持25℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______.
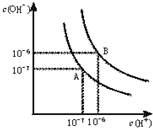
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从______增加到______.(填写具体数值)
(2)在25℃时将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持25℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______.

(1)A点25℃时,c(H+)=c(OH-)=1×10-7mol/L,Kw=c(H+)?c(OH-)=1×10-7×1×10-7=10-14;
100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw=c(H+)?c(OH-)=1×10-6×1×10-6=10-12,
故答案为:10-14;10-12;
(2)设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-6mol/L,
pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
欲使混合溶液pH=7,必须满足n(H+)=n(OH-),即1×10-6mol/L×xL=1×10-5mol/L×yL,
解得x:y=10:1,
故答案为:10:1.
100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw=c(H+)?c(OH-)=1×10-6×1×10-6=10-12,
故答案为:10-14;10-12;
(2)设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-6mol/L,
pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
欲使混合溶液pH=7,必须满足n(H+)=n(OH-),即1×10-6mol/L×xL=1×10-5mol/L×yL,
解得x:y=10:1,
故答案为:10:1.

练习册系列答案
相关题目