题目内容
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图: 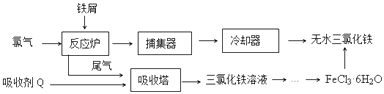
(1)由FeCl36H2O晶体制备无水FeCl3应采取的措施是: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000molL﹣1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32﹣=2I﹣+S4O62﹣
①写出加入稍过量的KI溶液反应的离子方程式.
②求样品中氯化铁的质量分数(写出计算过程)
【答案】
(1)在通HCl气体的氛围下加热
(2)加热浓缩;冷却结晶
(3)2.6×10﹣9
(4)解:①KI溶液与FeCl3发生氧化还原反应生成碘单质和二价铁,离子方程式为:2Fe3++2I﹣=2Fe2++I2;
②12.50mLNa2S2O3溶液含有Na2S2O3物质的量为12.50×10﹣3 L×0.1000molL﹣1=1.25×10﹣3mol,则:
根据关系式:
2Fe3+ | ~ | I2 | ~ | 2S2O32﹣ |
2 | 2 | |||
n(Fe3+) | 1.25×10﹣3mol×10 |
所以 n(Fe3+)=1.25×10﹣3mol×10=1.25×10﹣2mol,
所以2.300g无水氯化铁样品中氯化铁的质量为1.25×10﹣2mol×162.5g/mol=2.03125g
所以2.300g无水氯化铁样品中氯化铁的质量分数为 ![]() ×100%=88.32%;
×100%=88.32%;
故答案为:88.32%.
【解析】解:(1)因为Fe3+易水解生成挥发性的HCl,所以由FeCl36H2O晶体得到无水FeCl3 , 应在氯化氢气流中加热FeCl36H2O晶体,得到无水FeCl3 ,
所以答案是:在通HCl气体的氛围下加热;(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加加热浓缩,再冷却结晶;所以答案是:加热浓缩;冷却结晶;(3)当溶液pH为4时,溶液中c(OH﹣)=10﹣10mol/L,Ksp[Fe(OH)3]=c(Fe3+)c3(OH﹣)=2.6×10﹣39 , 所以溶液中c(Fe3+)= ![]() =2.6×10﹣9 molL﹣1 , 所以答案是:2.6×10﹣9;
=2.6×10﹣9 molL﹣1 , 所以答案是:2.6×10﹣9;

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:
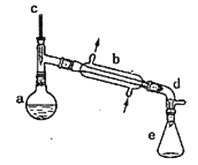
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。