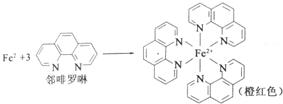
题目内容
17.可用X:X表示的分子是( )| A. | H2 | B. | Cl2 | C. | N2 | D. | O2 |
分析 分子晶体由分子构成,含有分子,离子晶体由离子构成、原子晶体由原子构成,离子晶体、原子晶体都不存在分子,用化学式表示,没有分子式,X表示分子,表明该物质必须是分子晶体,可用X:X表明构成X分子的原子,两原子间共用1对电子,据此分析解答.
解答 解:H2、Cl2、N2、O2都是分子晶体,H2、Cl2、N2、O2都可表示为分子式,可表示分子,
A.氢气分子中存在1个H-H共用电子对,氢气的电子式为H:H,可用X:表示,故A正确;
B.氯气分子中,2个氯原子通过共用一对电子,形成共价键,电子式为: ,可用X:表示,故B正确;
,可用X:表示,故B正确;
C.氮气分子中,两个氮原子形成了3对共用电子对,氮气的电子式为: ,不可用X:表示,故C错误;
,不可用X:表示,故C错误;
D.氧气中两个氧原子之间有2个共用电子对,其电子式为 ,不可用X:表示,故D错误;
,不可用X:表示,故D错误;
故选AB.
点评 本题主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成是正确解答本题的关键,题目难度不大.

练习册系列答案
相关题目
8.下列说法中,不正确的是( )
| A. | 石油裂解产物中有乙烯 | |
| B. | 天然气的主要成分是乙烯 | |
| C. | 芳香烃主要来自于煤干馏产生的煤焦油 | |
| D. | 汽油、煤油、柴油主要来自于石油的常压分馏 |
12.对反应A+3B?2C来说,下列反应速率中最快的是( )
| A. | υ(A)=0.3 mol/(L•min) | B. | υ(B)=0.6 mol/(L•min) | ||
| C. | υ(C)=0.5 mol/(L•min) | D. | υ(A)=0.01 mol/(L•s) |
6.下列有关实验的叙述正确的是( )
| A. | 将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系,n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 | |
| B. | 实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L | |
| C. | HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 | |
| D. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
 已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.
已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.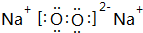 .它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.
.它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.
 ;
;