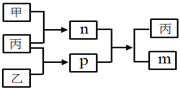
题目内容
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制如下转化关系图,图中A、B、C、D是由短周期元素组成的物质。

请回答:
(1)若A为单质,其焰色反应为黄色,C为淡黄色固体。
①组成A的元素在周期表中的位置是___________。
②下列说法正确的是___________(填字母)。
a. A可经一步反应转化为D
b. B、C均可作呼吸面具的供氧剂
c. B、C、D均可与CO2反应
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。
①C→D反应的化学方程式是___________。
②A与C反应生成E和水,E是空气中含量最多的气体。当生成19.6gE时,转移电子的物质的量为_________mol。
【答案】 第3周期第ⅠA族 a c 3NO2+H2O=2HNO3+NO↑ 2.4
【解析】根据转化关系图,若A为Na,Na常温下氧化生成Na2O,Na2O在空气中加热生成Na2O2,Na2O2和水反应生成NaOH和氧气;若A为NH3,NH3催化氧化生成NO,NO氧化生成NO2,NO2和水反应生成硝酸和一氧化氮;以此解答。
(1)A单质焰色反应为黄色为Na,Na常温下氧化生成Na2O,B为Na2O,Na2O在空气中加热生成Na2O2,C为淡黄色固体为Na2O2,Na2O2和水反应生成NaOH和氧气,则D为NaOH;
①钠元素在周期表中的位置是第3周期第ⅠA族。
②a. 钠与水反应生成氢氧化钠和氢气,a正确;b.Na2O不能作呼吸面具的供氧剂,b错误;c. Na2O、Na2O2和NaOH均可与CO2反应,c正确;故答案选ac。
(2)A为能使湿润的红色石蕊试纸变蓝的气体,一定为氨气,NH3催化氧化生成NO,NO氧化生成红棕色气体NO2,NO2和水反应生成硝酸和一氧化氮,即A为NH3,B为NO,C为NO2,D为硝酸。
①C→D反应的化学方程式是3NO2+H2O=2HNO3+NO↑。
②A与C反应生成E,E是空气中含量最多的气体为N2,反应的化学方程式为:![]() 。转移电子24e-
。转移电子24e-![]() 7N2,当生成19.6gN2时,转移电子的物质的量为
7N2,当生成19.6gN2时,转移电子的物质的量为![]() ×
×![]() =2.4mol。
=2.4mol。
因此,本题答案为:3NO2+H2O=2HNO3+NO↑ ;2.4。

【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).