题目内容
下列关于C、Si、S、Cl四种元素的说法中,正确的是
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4<SiH4<H2S<HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4<SiH4<H2S<HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
B
试题分析:A、Si、Cl主要存在于化合物中,自然界中存在游离态的C、S,故A错误;B.均为非金属元素,两两之间以共用电子对结合,则两两结合形成的化合物都是共价化合物,故B正确;C、非金属性越强,气态氢化物越稳定,则氢化物的热稳定性为SiH4<CH4<H2S<HCl,故C错误;D、非金属性越强,最高价氧化物对应水化物的酸性越强,则Si、C、S、Cl对应的酸性依次增强,但二氧化硅不与水反应,故D错误,答案选B。

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
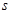 键与π键的键数之比为 。
键与π键的键数之比为 。