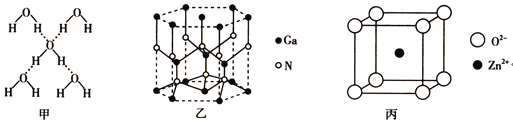
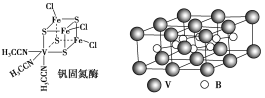
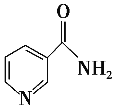
题目内容
【题目】下列叙述中正确的是( )
A.凡是盐在离子方程式中都要以离子的形式来表示
B.离子反应一定使溶液中所有离子的浓度都发生变化
C.复分解反应必须具备离子反应的某个条件
D.酸碱中和反应都能用离子方程式:H++OH-=H2O表示
【答案】C
【解析】难溶性盐用化学式表示,A项不符合题意;
离子反应中不一定所有离子的浓度均发生变化,B项不符合题意;
H2SO4和Ba(OH)2反应不能用H++OH-=H2O表示,D项不符合题意。
所以答案是:C

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深