��Ŀ����
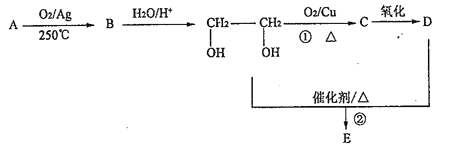
����Ŀ���±�ΪԪ�����ڱ���һ���������еı�Ŵ�������Ӧ��Ԫ�ء���ش��������⣺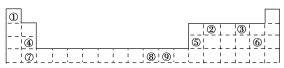
(1)����Ԫ�صĻ�̬ԭ�ӵļ۵����Ų�ʽ��________������ͬ�������һ�̬ԭ�ӵĺ���δ�ɶԵ���������Ԫ����______________________(д��Ԫ�ط���)������Ԫ�ػ�̬ԭ�ӵĵ����Ų�ͼΪ________��
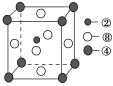
(2)����������Ԫ���γɵĺ���18���ӵ�����Ϊ________(д������)������������Ԫ���γɵ������������ЧӦ�����ʵ����幹��Ϊ________����������������Ԫ�ص�ԭ���γɵľ������侧���Ľṹ�ص���ͼ��ʾ����û�����Ļ�ѧʽΪ________(�ö�Ӧ��Ԫ�ط��ű�ʾ)�����������±�ϩ����̬������Է��������ȱ�ϩС�ļ״�������������ȴ��Һ̬���������������ԭ����_______________________________��
(3)����������Ԫ�����γɶ���ƽ���η�����������һ����Է���������С���йظ÷��ӵ�˵������ȷ����________��
a���÷������ں��м��Լ��ķǼ��Է���
b���÷��Ӻ���4���Ҽ���1���м�
c���÷����е�����ԭ�Ӳ�ȡsp2�ӻ�
d��������������ˮ�����ܺ�ˮ��Ӧ�õ��ƾ�
(4)ijԪ�صļ۵����Ų�ʽΪnsnnpn��1����Ԫ�ؿ���Ԫ�����γɺ���10�����ӵķ���X����������Xͨ��ʢ������ͭ��Һ���Թ���������������Ϊ_________________________��
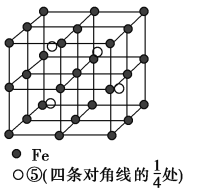
(5)��Ԫ������FeԪ���γɵ�ij�־�����ͼ��ʾ���������ı߳�Ϊa nm����Ͻ���ܶ�Ϊ________g��cm��3��
���𰸡�(1)3d104s1 Cr
![]()
![]()
(2)�������� ֱ���� MgNi3C(��Ni3MgC)
�״����Ӽ�������������ϩ���Ӽ�ֻ�з��»���
(3)ac
(4)�Ȳ�����ɫ�������������ʧ����Һ�������ɫ
(5)0.92/a3��5.56��1023/(a3NA)
��������(1)�����еĸ�Ԫ����Ԫ�����ڱ��е����λ������֪����Ԫ��ΪͭԪ�������̬ԭ�ӵļ۵����Ų�ʽΪ3d104s1������ͬ�������һ�̬ԭ�ӵĺ���δ�ɶԵ���������Ԫ�صĵ����Ų�ʽΪ[Ar]3d54s1���Ǹ�Ԫ�أ�����Ԫ��Ϊ̼Ԫ�������̬ԭ�ӵĵ����Ų�ͼΪ![]()
![]() ��
��
(2)����Ԫ����������Ԫ�����γɵĺ���18���ӵ�����ΪH2O2������Ԫ��̼������Ԫ�����γɵ����������ЧӦ�����ʶ�����̼�Ŀռ乹��Ϊֱ���Σ����ݾ����Ľṹ���þ�̯���ж���1�������к���1��̼ԭ����þԭ��Ϊ8��1/8��1������ԭ��6��1/2��3��������C��Mg��Ni����Ԫ�ص�ԭ�ӹ��ɵľ���Ļ�ѧʽΪMgNi3C��Ni3MgC�������±�ϩΪ��̬������Է��������ȱ�ϩС�ļ״�������ȴ��Һ̬���������������ԭ���Ǽ״����Ӽ�������������ϩ���Ӽ�ֻ�з��»�����(3)C��H����Ԫ�����γɶ���ƽ���η�����������Է���������С��Ϊ��ϩ��a�����÷�����̼���Ϊ���Լ������ӽṹ�Գ������ں��м��Լ��ķǼ��Է�������ȷ��b�����÷��Ӻ���4��̼�����1��̼̼˫��������5���Ҽ���1���м�������c�����÷���Ϊƽ������̼ԭ�Ӳ�ȡsp2�ӻ�����ȷ��d����������������ˮ������ѡac��(4)ijԪ�صļ۵����Ų�ʽΪnsnnpn��1����Ԫ��Ϊ��Ԫ��������Ԫ�����γɺ���10�����ӵİ����������������İ���ͨ��ʢ������ͭ��Һ���Թ������ȷ������ֽⷴӦ����Cu(OH)2������������Ϸ�Ӧ����[Cu(NH3)4]SO4������������Ϊ���Ȳ�����ɫ�������������ʧ����Һ�������ɫ��(5)���ݾ����Ľṹ��ȷ��1�������к��и�ԭ�ӵĸ�������һ��ȷ���仯ѧʽ������ܶȵĶ��弰�����ѧ֪ʶ���м������úϽ���ܶ�Ϊ0.92/a3��5.56��1023/(a3NA)��

 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�����Ŀ���̵Ļ���������϶࣬�����й㷺����;��
��.MnO2��H2O2�ֽ�����õĴ�������Ҳ���н�ǿ�������ԡ�ij��ѧ��ȤС��ͨ��ʵ��̽��MnO2�����ʡ�
��С�����������4����������֤MnO2�������ԣ����е���__________������ţ���
��MnO2������뵽ϡ�����У��۲��Ƿ��л���ɫ��������
��MnO2������뵽H2O2��Һ�У��۲��Ƿ������ݲ���
Na2SO3��Һ�У�����MnO2���壬�ٵμ�BaCl2��Һ���۲��Ƿ��а�ɫ��������
FeSO4��Һ�еμӼ���KSCN��Һ���ټ���MnO2���壬�۲���Һ�Ƿ���
Ϊ�о���Һ��MnO2��������������Һ����ԵĹ�ϵ����С��ͬѧ��������µĶԱ�ʵ�飺�������£�ȡA��B��C��֧�Թܣ���ͬŨ��ͬ�����KI��Һ��������������С��ͬ��MnO2���巴Ӧ��Ȼ��ֱ����1mL0.2mol/L NaOH��Һ��1mLˮ��1mL0.1mol/Lϡ���ᡣ�����¼�����ʾ��
�Թܱ�� | ʵ������ |
A | ��Һ����ɫ |
B | ��Һ������dz�غ�ɫ |
C | ��ҺѸ�ٱ��غ�ɫ |
�ٴ�����ʵ���У����ǿ��Եó��Ľ�����_____________________��
��д��C�Թ��з�����Ӧ�����ӷ���ʽ��_______________________��
��.�����̣�MnFe2O4���������Ȼ�ѧѭ���ֽ�ˮ���⣬����Ч������ԴΣ����MnFe2O4���Ʊ�����������ͼ��

��֪��Fe3+��Mn2+������pH�������ʾ��
��ʼ���� | ��ȫ���� | |
Fe3+ | 2.7 | 4.2 |
Mn2+ | 8.3 | 10.4 |
����һ��Ͷ��ԭ��Fe��NO3��3��Mn��NO3��2�����ʵ���֮��������ӦΪ_________________��
������������pH�ķ�Χ��_________________��
���������Ƿ�ϴ�Ӹɾ����жϷ�����_____________________��