题目内容
【题目】一定量混合物在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
A.m+n<pB.平衡向逆反应方向移动C.A的转化率降低D.C的体积分数增大
【答案】D
【解析】
加压时,假如平衡不移动,这时物质的浓度应该是原来的2倍。但B物质的浓度为原来的1.9倍,说明增大压强,化学平衡向正反应方向移动。反应物的转化率提高。根据勒夏特列原理可知:增大压强,化学平衡向气体体积减小的方向移动。正反应方向是气体体积减小的反应。所以m+n>p 。A、B、C错误。化学平衡向正反应方向移动,生成更多的产物,所以C的体积分数增大。答案为:D。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向FeBr2溶液中通入适量Cl2,溶液由浅绿色变为黄色 | Cl2氧化性强于Br2 |
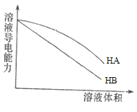
B | 常温下,等体积pH=3的HA和HB两种酸分别加水稀释,溶液导电能力如图
| HA酸性比HB弱 |
C | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X具有氧化性 |
D | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | 气体为氧气 |
A.AB.BC.CD.D
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____,直到因加入一滴盐酸后,溶液由______色变为____色,并____为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,所用盐酸溶液的体积为_____mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 25.31 | 25.09 |
依据表中数据列式计算该NaOH溶液的物质的量浓度_____(保留两位小数)。