题目内容
下列对一些实验事实和理论解释正确的是( )
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A | NH3溶于水形成的溶液微弱导电 | NH3是弱电解质 |
| B | K的熔点 高于Na | K金属性比Na的金属性强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A、A | B、B | C、C | D、D |
考点:强电解质和弱电解质的概念,离子化合物的结构特征与性质,碱金属的性质
专题:基本概念与基本理论
分析:A.氨气本身不能发生电离;
B.碱金属元素从上到下,金属的熔点逐渐降低;
C.该物质熔融状态下能导电属于离子晶体;
D.HF的沸点高于HCl,是因HF分子间存在氢键.
B.碱金属元素从上到下,金属的熔点逐渐降低;
C.该物质熔融状态下能导电属于离子晶体;
D.HF的沸点高于HCl,是因HF分子间存在氢键.
解答:
解:A.NH3溶于水形成的溶液微弱导电,是因氨气与水反应生成一水合氨电离生成离子,而氨气为非电解质,一水合氨为弱电解质,故A错误;
B.碱金属元素从上到下,金属的熔点逐渐降低,所以熔点Na>K,故B错误;
C.该物质在熔融状态下能导电,则为离子晶体,1molK3C60中含有3mol阳离子,1mol阴离子,故C正确;
D.HF含有氢键,沸点较高,属于分子间作用力的一种,但与F的非金属性比Cl强无关,故D错误;
故选C
B.碱金属元素从上到下,金属的熔点逐渐降低,所以熔点Na>K,故B错误;
C.该物质在熔融状态下能导电,则为离子晶体,1molK3C60中含有3mol阳离子,1mol阴离子,故C正确;
D.HF含有氢键,沸点较高,属于分子间作用力的一种,但与F的非金属性比Cl强无关,故D错误;
故选C
点评:本题考查化学实验方案的评价,为高频考点,涉及电解质、金属的熔点比较及化学键、氢键等知识的考查,侧重物质的性质及分析能力的考查,注意实验操作的评价性分析,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
有机反应的类型很多,下列各反应中与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A、C2H5Cl→CH2═CH2 |
| B、CH3CHO→C2H5OH |
C、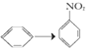 |
| D、CH3COOH→CH3COOC2H5 |
把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L?min),下列说法错误的是( )
| A、x=2 |
| B、B的转化率为20% |
| C、平衡时A的浓度为0.8mol/L |
| D、恒温达平衡时容器内的压强与开始时相等 |
下列有关银镜反应实验的说法正确的是( )
| A、试管要用浓硫酸和蒸馏水洗涤 |
| B、采用水浴加热,不能直接加热 |
| C、向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液 |
| D、可用浓盐酸洗去银镜 |
苯分子中不存在碳碳单、双键的交替结构,下列可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环已烷
④苯分子中碳碳键长完全相等
⑤邻二氯苯( )只有一种
)只有一种
⑥间二氯苯(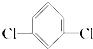 )只有一种.
)只有一种.
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环已烷
④苯分子中碳碳键长完全相等
⑤邻二氯苯(
 )只有一种
)只有一种⑥间二氯苯(
 )只有一种.
)只有一种.| A、①② | B、①⑤ |
| C、③④⑤⑥ | D、①②④⑤ |
可逆反应:2HI(g)?H2(g)+I2(g);△H>0.在密闭容器中进行,当达到平衡时欲使混合气体的颜色加深,应采取的措施( )
| A、增大容器体积 |
| B、降低温度 |
| C、加入催化剂 |
| D、充入I2气体 |
下列有关化学用语使用正确的是( )
A、甲烷分子的球棍模型: |
B、H2O2的电子式: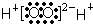 |
C、硫原子的结构示意图: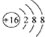 |
| D、次氯酸分子的结构式:H-O-Cl |
下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ | ||||
B、C+H2O
| ||||
| C、CO2+NH3+H2O═NH4HCO3 | ||||
| D、2F2+2H2O═4HF+O2 |