题目内容
下列有关实验的叙述正确的是( )

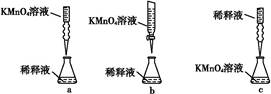
| A.可用碱式滴定管量取12. 85 mL的KMnO4溶液 |
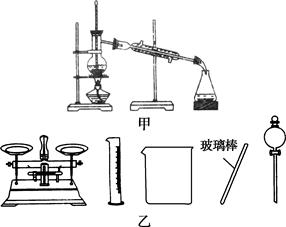
| B.实验室蒸馏石油可用如图甲所示实验装置 |
| C.取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
| D.配制500 mL 0.4 mol·L-1NaCl溶液,必要的仪器如图乙所示 |
C
A中KMnO4溶液具有强氧化性,不能用碱式滴定管量取;B中的温度计水银球反应位于蒸馏烧瓶支管口处; D中不需要分液漏斗,而需要容量瓶。

练习册系列答案
相关题目
 。
。
 Ag+ + SCN-,Ksp="1.0" ×10-12 ;Fe3+ + SCN-
Ag+ + SCN-,Ksp="1.0" ×10-12 ;Fe3+ + SCN- 

 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。