题目内容
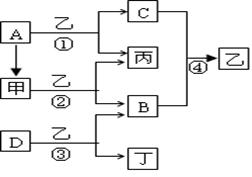
A、B、C、D为常见气态单质.已知:
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子E、F中都含有10个电子;
③C和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀.
(1)E与J按物质的量2:1通入F中得到的溶液中存在的四个平衡体系,(用方程式表示):
已知该溶液呈碱性,溶液中离子浓度由大到小的顺序为
(2)A、C、D所含元素可组成一种离子化合物R,该化合物R在重水D2O中发生水解反应的化学方程式是
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子E、F中都含有10个电子;
③C和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀.
(1)E与J按物质的量2:1通入F中得到的溶液中存在的四个平衡体系,(用方程式表示):
H2O?H++OH-
H2O?H++OH-
、NH3+H2O?NH3?H2O
NH3+H2O?NH3?H2O
、NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
、NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.已知该溶液呈碱性,溶液中离子浓度由大到小的顺序为
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(2)A、C、D所含元素可组成一种离子化合物R,该化合物R在重水D2O中发生水解反应的化学方程式是
NH4Cl+D2O?NH3?HDO+DCl
NH4Cl+D2O?NH3?HDO+DCl
.分析:A、B、C、D为常见气态单质.
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体,则A为氮气,B为氧气,二者反应生成NO与氧气反应生成红棕色的NO2;
②C分别与N2、O2反应生成的两种化合物分子E、F中都含有10个电子,则E、F分别为NH3、H2O,所以C为H2;
③H2和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀,则J为HCl,D为Cl2;然后根据各物质的性质分析.
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体,则A为氮气,B为氧气,二者反应生成NO与氧气反应生成红棕色的NO2;
②C分别与N2、O2反应生成的两种化合物分子E、F中都含有10个电子,则E、F分别为NH3、H2O,所以C为H2;
③H2和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀,则J为HCl,D为Cl2;然后根据各物质的性质分析.
解答:解:A、B、C、D为常见气态单质.
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体,则A为氮气,B为氧气,二者反应生成NO与氧气反应生成红棕色的NO2;
②C分别与N2、O2反应生成的两种化合物分子E、F中都含有10个电子,则E、F分别为NH3、H2O,所以C为H2;
③H2和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀,则J为HCl,D为Cl2;
(1)NH3和HCl按物质的量2:1通入H2O中,则反应后溶液中溶质为等物质的量的NH4Cl和NH3?H2O,所以溶液中存在的四个平衡体系为:H2O?H++OH-;NH3+H2O?NH3?H2O;NH4++H2O?NH3?H2O+H+;NH3?H2O?NH4++OH-;
已知该溶液呈碱性,则以NH3?H2O的电离为主,所以溶液中离子浓度由大到小的顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:H2O?H++OH-;NH3+H2O?NH3?H2O;NH4++H2O?NH3?H2O+H+;NH3?H2O?NH4++OH-;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)A、C、D所含元素可组成一种离子化合物R,则R为NH4Cl,NH4Cl在重水D2O中发生水解反应的化学方程式:NH4Cl+D2O?NH3?HDO+DCl,
故答案为:NH4Cl+D2O?NH3?HDO+DCl.
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体,则A为氮气,B为氧气,二者反应生成NO与氧气反应生成红棕色的NO2;
②C分别与N2、O2反应生成的两种化合物分子E、F中都含有10个电子,则E、F分别为NH3、H2O,所以C为H2;
③H2和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀,则J为HCl,D为Cl2;
(1)NH3和HCl按物质的量2:1通入H2O中,则反应后溶液中溶质为等物质的量的NH4Cl和NH3?H2O,所以溶液中存在的四个平衡体系为:H2O?H++OH-;NH3+H2O?NH3?H2O;NH4++H2O?NH3?H2O+H+;NH3?H2O?NH4++OH-;
已知该溶液呈碱性,则以NH3?H2O的电离为主,所以溶液中离子浓度由大到小的顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:H2O?H++OH-;NH3+H2O?NH3?H2O;NH4++H2O?NH3?H2O+H+;NH3?H2O?NH4++OH-;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)A、C、D所含元素可组成一种离子化合物R,则R为NH4Cl,NH4Cl在重水D2O中发生水解反应的化学方程式:NH4Cl+D2O?NH3?HDO+DCl,
故答案为:NH4Cl+D2O?NH3?HDO+DCl.
点评:本题考查了物质的推断,弱电解质的电离平衡,盐类水解,离子浓度大小的比较,综合性较强,需要熟练掌握基础才能综合应用.

练习册系列答案
相关题目