题目内容
【题目】高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/mol
ii.SO3(g)分解.
(1)SO3(g)分解的热化学方程式为
(2)工业上常用SO2制备Na2S2O3 , 向0.1mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为 .
(3)反应ii的△S0 (填“>”、“<”、“=”).
(4)对反应ii,可用V2O5作催化剂. 已知:SO2+V2O5SO3+V2O4K1、 ![]() O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
(5)L(L1、L2),X可分别代表压强或温度,如图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系. 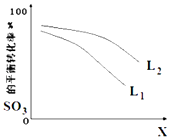
①X代表的物理量是;
②比较L1、L2的大小 .
(6)维持体系总压p恒定,在T℃时,物质的量为9mol、体积为2L的SO3(g)发生反应:2SO3(g)2SO2(g)+O2(g),已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=(用最简分数表示).
【答案】
(1)2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol
(2)S2O32﹣+2H+=S↓+SO2↑+H2O
(3)>
(4)![]()
(5)压强;L2>L1
(6)![]() mol/L
mol/L
【解析】解:(1)已知:①2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol﹣1②H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol﹣1
根据盖斯定律①﹣2×②可得:2SO3(g)=2SO2(g)+O2(g)△H=+196 kJ/mol;
所以答案是:2SO3(g)=2SO2(g)+O2(g)△H=+196 kJ/mol;(2)Na2S2O3溶液中滴加稀硫酸制备二氧化硫的方程为:S2O32﹣+2H+=S↓+SO2↑+H2O;
所以答案是:S2O32﹣+2H+=S↓+SO2↑+H2O;(3)反应气体体积增多,△S>0;
所以答案是:>;(4)已知::①SO2+V2O5SO3+V2O4 K1 , ![]() O2+V2O4V2O5 K2 ,
O2+V2O4V2O5 K2 ,
则﹣(①+②)×2可得2SO3(g)2SO2(g)+O2(g),K= ![]() ;
;
所以答案是: ![]() ;(5)①)①由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
;(5)①)①由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
所以答案是:压强;
②由SO3(g)=SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大;
所以答案是:L2>L1;(6)在T℃时,物质的量为9mol、体积为2L的SO3(g)发生反应,SO3的平衡转化率25%,
2SO3(g) | 2SO2(g)+ | O2(g) | ||
起始量(mol): | 9 | 0 | 0 | |
转化量(mol): | 2.25 | 2.25 | 1.125 | |
平衡量(mol): | 6.75 | 2.25 | 1.125 |
维持体系总压p恒定,平衡时容器的体积为V,则 ![]() ,V=2.25L,则平衡常数K=
,V=2.25L,则平衡常数K= ![]() =
= ![]() mol/L;
mol/L;
所以答案是: ![]() mol/L.
mol/L.
【考点精析】通过灵活运用反应热和焓变和化学平衡的计算,掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

