题目内容
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
C
试题分析:A、氧化性是Ce4+>I2,因此Ce4+和I-不能共存,所以选项A不正确;B、根据氧化性是Ce4+>Fe3+>I2可知,应该发生的反应为Ce4++Fe2+=Ce3++Fe3+,故B不正确;C、电解池中阴极得到电子,阳极失去电子,所以电解熔融状态的CeO2时,在阴极上是Ce4+得电子生成单质铈的过程,即在阴极获得铈,故C正确;D、同素异形体是同种元素组成的不同单质间的互称,四种铈的核素
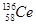 、
、 、
、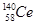 、
、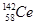 它们互称为同位素,故D错误,答案选C。
它们互称为同位素,故D错误,答案选C。
练习册系列答案
相关题目
 xOH-+ N2+4H2O。下列有关说法正确的是
xOH-+ N2+4H2O。下列有关说法正确的是
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。 HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。

