题目内容
某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3.C.N2.AlN.CO
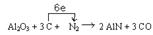
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目

(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目

(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
(1)
 (4分)
(4分)(2)(2分) 5.6 L (3)(2分)AB
试题分析:(1)由化合价升降法配平,C(0)→CO :C(+2) C升高2;N2:2N(0)→2AlN;2N(0)→ 2N(-3),N降低6 ,最小公倍数6,C和CO前填3 ;AlN前填2;其他观察法配平。电子由C
转移给N2, 共6e。
(2)设该反应产生气体的体积为x
3CO------------6e-
3*22.4 6*6.02×1023
x 3.01 ×1023 x= 5.6 L
则该反应产生气体的体积为5.6 L。
(3)A.正确,越稳定,键能越高,破坏它需要的能量越高,错误;B.都是固体,易混在一起,正确;C.前者氮化铝为还原产物,后者不是氧化还原反应,氮化铝不为还原产物,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。 Ce、
Ce、 Ce、
Ce、 Ce、
Ce、 Ce,它们互称为同素异形体
Ce,它们互称为同素异形体 下列说法正确的是
下列说法正确的是