题目内容
在室温下,0.1mol/L 100ml的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取
| A.加入少量CH3COONa固体 | B.通入少量HCl气体 |
| C.升高温度 | D.加入水 |
B
醋酸溶液中存在如下电离平衡: ?
? ;所以
;所以
A错,加入少量CH3COONa固体,溶液中 增大,平衡逆向移动,溶液中氢离子浓度减小,溶液的PH增大;B正确;C错,醋酸的电离是吸热过程,升高温度平衡向右移动,溶液中氢离子浓度增大,溶液的PH减小,醋酸的电离程度增大;D错,加水稀释,醋酸的电离程度增大,但溶液的氢离子浓度减小,溶液的PH增大;
增大,平衡逆向移动,溶液中氢离子浓度减小,溶液的PH增大;B正确;C错,醋酸的电离是吸热过程,升高温度平衡向右移动,溶液中氢离子浓度增大,溶液的PH减小,醋酸的电离程度增大;D错,加水稀释,醋酸的电离程度增大,但溶液的氢离子浓度减小,溶液的PH增大;
 ?
? ;所以
;所以A错,加入少量CH3COONa固体,溶液中
 增大,平衡逆向移动,溶液中氢离子浓度减小,溶液的PH增大;B正确;C错,醋酸的电离是吸热过程,升高温度平衡向右移动,溶液中氢离子浓度增大,溶液的PH减小,醋酸的电离程度增大;D错,加水稀释,醋酸的电离程度增大,但溶液的氢离子浓度减小,溶液的PH增大;
增大,平衡逆向移动,溶液中氢离子浓度减小,溶液的PH增大;B正确;C错,醋酸的电离是吸热过程,升高温度平衡向右移动,溶液中氢离子浓度增大,溶液的PH减小,醋酸的电离程度增大;D错,加水稀释,醋酸的电离程度增大,但溶液的氢离子浓度减小,溶液的PH增大;
练习册系列答案
相关题目
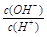 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是 发性
发性 离
离
 的比值 (填“增大”、“减小”或“不变”)。
的比值 (填“增大”、“减小”或“不变”)。 CH3COO— +H+ 对于该平衡,下列叙述正确的是( )
CH3COO— +H+ 对于该平衡,下列叙述正确的是( ) mol/L的H2S溶液中,下列关系正确的是
mol/L的H2S溶液中,下列关系正确的是 (HS-)+c(S2-)
(HS-)+c(S2-)