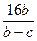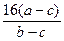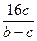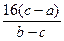题目内容
质量相等的SO2与SO3,前者与后者所含氧原子个数之比是( )
| A.1∶1 | B.2∶3 | C.6∶5 | D.5∶6 |
D
为方便计算,设m(SO2)=m(SO3)="1" g,则
n(SO2中O原子)=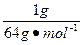 ×2=
×2= mol。
mol。
n(SO3中O原子)= ×3=
×3=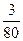 mol。
mol。
由于O原子个数之比等于O原子物质的量之比,所以答案为:
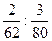 =5∶6。
=5∶6。
解法二:依据n= 可知,质量相等时,两种物质的物质的量与其摩尔质量成反比,故可先求SO2和SO3的物质的量比,再求氧原子的个数比,因此有
可知,质量相等时,两种物质的物质的量与其摩尔质量成反比,故可先求SO2和SO3的物质的量比,再求氧原子的个数比,因此有
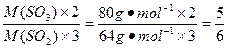 。
。
n(SO2中O原子)=
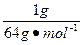 ×2=
×2= mol。
mol。n(SO3中O原子)=
 ×3=
×3=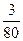 mol。
mol。由于O原子个数之比等于O原子物质的量之比,所以答案为:
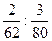 =5∶6。
=5∶6。解法二:依据n=
 可知,质量相等时,两种物质的物质的量与其摩尔质量成反比,故可先求SO2和SO3的物质的量比,再求氧原子的个数比,因此有
可知,质量相等时,两种物质的物质的量与其摩尔质量成反比,故可先求SO2和SO3的物质的量比,再求氧原子的个数比,因此有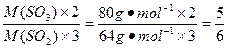 。
。
练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
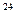 个氯化氢分子④147 g硫酸
个氯化氢分子④147 g硫酸