题目内容
【题目】短周期元素X和Y组成化合物X2Y,那么X和Y所在族的序数不可能分别是
A.ⅠA和ⅦAB.ⅠA和ⅥA
C.ⅦA和ⅥAD.ⅤA和ⅥA
【答案】A
【解析】
A.如为ⅠA和ⅦA,则对应化合物为XY,故A错误;
B.如为ⅠA和ⅥA,则对应化合物为X2Y,例如H2O等,故B正确;
C.如为ⅦA和ⅥA,对应化合物可为X2Y,例如Cl2O等,故C正确;
D.如为ⅤA和ⅥA,可为N2O等,故D正确;
故答案为A。

【题目】某工业废料中含有 Cr(OH)3、Al2O3、CuO、NiO 等物质,工业上通过下列流程回收其中有用的金属和制取 Na2Cr2O7。
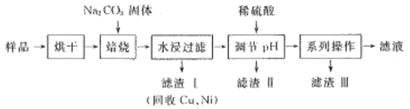
已知:①“水浸过滤”后的溶液中存在 Na2CrO4、NaAlO2 等物质
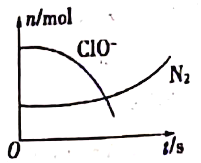
②除去滤渣 II 后,溶液中存在反应 2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③Na2Cr2O7、Na2CrO4 在不同温度下的溶解度(g/100 g H2O)如下表:
20℃ | 60℃ | 100℃ | |
Na2Cr2O7 | 183 | 269 | 415 |
Na2CrO4 | 84 | 115 | 126 |
(1)“焙烧”过程中生成 NaAlO2 的化学方程式为_____。
(2)生成滤渣时,需加入适量稀硫酸调节溶液的 pH 除去 AlO2 -,若稀硫酸过量,则因过量引起反应的离子方程式为_______________________。
(3)“系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_________;滤渣 III 中除含有少量硫酸钠晶体外,主要成分是 _________________(写化学式)。
(4)工业上还可以在“水浸过滤”后的溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为 ____。
(5)流程图最后的“滤液”中仍然有残留的 Na2Cr2O7。Cr 为重金属元素,若含量过高就排入河流中, 会对河水造成重金属污染。为测定“滤液”中的 c(Na2Cr2O7),某实验小组取“滤液”20 mL,加水稀释至 250 mL,再取稀释后的溶液 25 mL 于锥形瓶中,用 c mol/L的 FeSO4 溶液进行氧化还原滴定,到终点 时清耗 FeSO4 溶液体积为 V mL[已知发生的反应为Na2Cr2O7+FeSO4+H2SO4→Na2SO4+Cr2(SO4)3+ Fe2(SO4)3+ H2O(未配平)],则“滤液”中的c(Na2Cr2O7)=_________mol/L。